
【题目】下列物质属于纯净物的是( )
A.液氯
B.氯水
C.盐酸
D.漂白粉
科目:高中化学 来源: 题型:
【题目】目前人类已发现几千万种物质,对物质进行分类,有利于我们的学习.下列物质的分类不正确的是( )
A.SO2(氧化物)
B.碘酒(单质)
C.HNO3(含氧酸)
D.氯水(混合物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用生物电化学方法脱除水体中NH4+的原理如图所示。
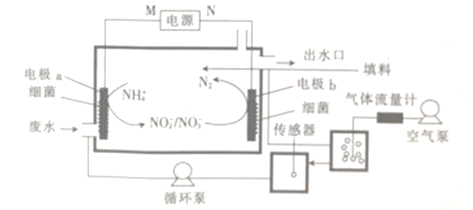
下列说法正确的是
A. M为电源的负极,N为电源的正极
B. 装置工作时,电极a周围溶液的pH降低
C. 装置内工作温度越高,NH4+的脱除率一定越大
D. 电极b上发生的反应之一为2NO2-+8H++8e-=N2↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)掺杂硒的纳米氧化亚铜常用作光敏材料、能源行业催化剂等。
(1)酸性溶液中Na2SO3将H2SeO2和H2SeO4还原为硒单质的反应如下:
H2SeO3(aq)+2SO2(g)+H2O(l)=Se(s)+2H2SO4(aq) △H1
2H2SeO4(aq)+Se(s)+H2O(l)=3H2SeO3(aq) △H2
H2SeO4(aq)+3SO2(g)+2H2O(l)=Se(s)+3H2SO4(aq) △H3
则△H2=_____________(用△H1和△H3表示)。
(2)H2S与CO2在纳米Cu2O催化作用下反应可生成羰基硫(COS),羰基硫的结构式为____________________。
(3)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及溶液中物质的有关转化如图1所示,
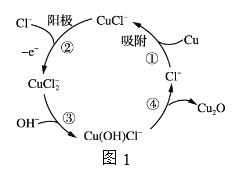
①阳极的电极反应式为_________________________。
②电解一段时间后,向电解液中补充一定量的_________________可将溶液恢复至初始状态。
(4)掺杂硒的纳米Cu2O催化剂可用于工业上合成甲醇:
CO(g)+2H2(g) ![]() CH3OH(g) △H=akJ·mol-1。
CH3OH(g) △H=akJ·mol-1。
按![]() =1的投料比将H2与CO充入VL的恒容密团容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图2所示。
=1的投料比将H2与CO充入VL的恒容密团容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图2所示。
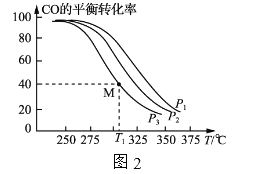
①a_____(填“>”或“<”)0;压强p1、p2、p3由小到大的顺序是___________________。
②T1℃时若向该容器中充入2.0molH2和2.0molCO发生上述反应,5min后反应达到平衡(M点),则0~5min内,v(H2)=____mol·L-1·min-1,M点对应条件下反应的平衡常数
为________________。
(5)将CuCl水解再热分解可得到纳米Cu2O。CuCl水解的反应为CuC(s) +H2O(l) ![]() CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=________________。
CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Q是一种治疗关节炎的止痛药,合成Q的路线如下:

(1)A的名称为_______________。D中官能团的名称为_________________。
(2)E→F的反应类型为_______________。G→M的反应类型为_______________。
(3)B与(ClCH2CO)2O反应生成C和另一有机物H,该反应的化学方程式为_______________。
(4)有机物J为M的同分异构体。J有多种结构,写出满足下列条件的J的所有结构简式____________。
①苯环上只有两个取代基 ②能发生银镜反应
③核磁共振氢谱图中只有5组吸收峰,且峰面积之比为9:2:2:2:1
④酸性条件下能发生水解反应,且水解产物之一能与氧化铁溶液发生显色反应
(5)请写出以1-丙醇、苯、乙酸酐[(CH3CO)2O]为原料合成 的路线流程图(无机试剂任用,合成路线流程图示例见本题干):__________________________。
的路线流程图(无机试剂任用,合成路线流程图示例见本题干):__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:
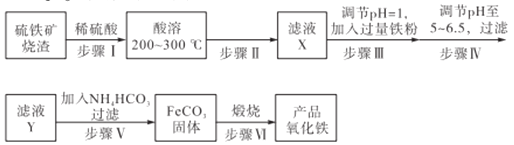
试回答下列问题:
(1)实验室实现“步骤II”中分离操作所用的玻璃仪器有____、玻璃棒和烧杯等;该步骤是为了除去_______(填相关物质的化学式)。
(2)检验步骤III已经进行完全的操作是_______________________。
(3)步骤V的反应温度一般需控制在35℃以下,其目的是______________;该步骤中反应生成FeCO3的离子反应方程式为___________。
(4)步骤VI中发生反应的化学反应方程式为____________________。
(5)步骤V中,FeCO3达到沉淀溶解平衡时,若c(Fe2+)=1×10-6mol/L,欲使所得的FeCO3中不含有Fe(OH)2,应控制溶液的pH≤_____(已知:Ksp[Fe(OH)2]=4.9×10-17,lg7=0.8)。
(6)欲测定硫铁矿矿渣中Fe元素的质量分数,称取ag样品,充分“酸溶” “水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg,测得该样品中Fe元素的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的第二、三周期主族元素,A、B、C的单质(用a、b、c表示)与化合物x、y、z有如图所示的转化关系,B与D同主族。下列说法正确的是

A. 化合物y阴阳离子个数比为1:1
B. 简单离子半径:D>C>B
C. 最高价氧化物对应的水化物的酸性:A>D
D. A与D形成的化合物AD2中各原子均满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com