
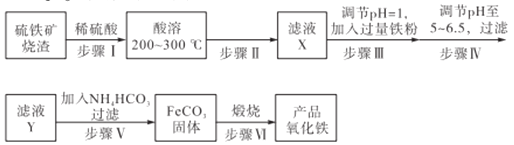
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:
试回答下列问题:
(1)实验室实现“步骤II”中分离操作所用的玻璃仪器有____、玻璃棒和烧杯等;该步骤是为了除去_______(填相关物质的化学式)。
(2)检验步骤III已经进行完全的操作是_______________________。
(3)步骤V的反应温度一般需控制在35℃以下,其目的是______________;该步骤中反应生成FeCO3的离子反应方程式为___________。
(4)步骤VI中发生反应的化学反应方程式为____________________。
(5)步骤V中,FeCO3达到沉淀溶解平衡时,若c(Fe2+)=1×10-6mol/L,欲使所得的FeCO3中不含有Fe(OH)2,应控制溶液的pH≤_____(已知:Ksp[Fe(OH)2]=4.9×10-17,lg7=0.8)。
(6)欲测定硫铁矿矿渣中Fe元素的质量分数,称取ag样品,充分“酸溶” “水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg,测得该样品中Fe元素的质量分数为______。
【答案】 漏斗 SiO2 取歩骤III反应后的溶液少量试管中,加入少量KSCN溶液,若溶液未呈现血红色,则说明已经进行完全 防止NH4HCO3分解、减少Fe2+的水解 2HCO3-+Fe2+=FeCO3↓+CO2↑+H2O 4FeCO3+O2![]() 2Fe2O3+4CO2 8.8 7b/10a
2Fe2O3+4CO2 8.8 7b/10a
【解析】分析: 硫铁矿烧渣经稀硫酸溶解后,过滤除去不溶物SiO2,向滤液中加入过量的铁粉调节溶液的pH=1,待溶液中检验不出Fe3+后,再调节pH至5~6.5,过滤除去过量的铁粉,向滤液中加入碳酸氢铵沉淀Fe2+,过滤得到碳酸亚铁,最后在空气中煅烧碳酸亚铁得到氧化铁。
详解:(1)实验室实现“步骤II”中分离操作所用的玻璃仪器有漏斗、玻璃棒和烧杯等;该步骤是为了除去SiO2。
(2)检验步骤III已经进行完全的操作是:取歩骤III反应后的溶液少量试管中,加入少量KSCN溶液,若溶液未呈现血红色,则说明已经进行完全。
(3)步骤V的反应温度一般需控制在35℃以下,其目的是:防止NH4HCO3分解、减少Fe2+的水解;该步骤中反应生成FeCO3的离子反应方程式为2HCO3-+Fe2+=FeCO3↓+CO2↑+H2O。
(4)步骤VI中发生反应的化学反应方程式为4FeCO3+O2![]() 2Fe2O3+4CO2。
2Fe2O3+4CO2。
(5)步骤V中,FeCO3达到沉淀溶解平衡时,若c(Fe2+)=1×10-6mol/L,欲使所得的FeCO3中不含有Fe(OH)2,应控制溶液的c(![]() )
)![]() ,则
,则![]() ,所以,pH≤8.8。
,所以,pH≤8.8。
(6)由题意可知,称取ag样品,充分“酸溶” “水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得氧化铁的质量为bg,则m(Fe)=![]() ,所以,该样品中Fe元素的质量分数为
,所以,该样品中Fe元素的质量分数为![]() 。
。


科目:高中化学 来源: 题型:
【题目】0.10 mol镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为( )
A. 3.2 g B. 4.0 g C. 4.2 g D. 4.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为测定一定质量的钠与水反应产生的氢气的体积,设计了图装置进行实验。
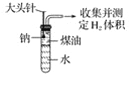
(1)实验开始,欲使钠与水接触反应,应如何操作?______________________________;反应开始后,试管中能观察到的现象是__________________________________________。
(2)已知有关物质的密度ρ(K):0.86 g·cm-3,ρ(Na):0.97 g·cm-3,ρ(煤油):0.8 g·cm-3。如果将钠换成相同大小的钾进行上述实验,结果钾反应完所用时间比钠反应完所用的时间________(填“长”或“短”),其原因是________________________________。
(3)从实验的安全考虑,比较金属钠、钾与水反应的实验操作图A、图B,请指出图B表示哪种金属与水反应____________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,采用了不同的实验方法(装置如图所示)。


(1)根据上图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)____。
(2)图Ⅲ所示实验能够鉴别这两种物质,其反应的化学方程式为_______。
(3)图Ⅳ不仅能鉴别碳酸钠和碳酸氢钠,同时又能验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的物质为__________,实验过程中的现象为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.加热杀死流感H7N9病毒是因为蛋白质受热发生盐析
B.医用酒精灭活新冠肺炎病毒是利用其氧化性
C.我国研制的重组新冠疫苗无需冷藏保存
D.乙烯的产量通常用来衡量一个国家石油化工的水平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2,5-己二醇(C6H14O2)可以作为医药中间体和制备高分子聚合物的原料。2,5-已二醇和聚酯的合成路线如图所示:

回答下列问题:
(1)A中所含官能团的名称为______,E的名称为______。
(2)D→E的反应类型是______,A→D的反应条件是______ 。
(3)A→B反应的化学方程式为______ 。
(4)G→I反应的化学方程式为______ 。
(5)物质H的同分异构体有多种,同时满足下列三个条件的共有___种,其中核磁共振氢谱为三组峰的是______ (写结构简式)。
①能发生银镜反应;②能与碳酸氢钠溶液反应;③能发生水解反应。
(6)参照上述合成路线,以苯和乙醛为原料(其他试剂任选),设计制备苯乙烯的合成路线。______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由B、N及Mg、Ni等元素组成的新型材料有着广泛的用途,回答下列向题:
(1)Ni2+元素基态原子的电子排布式为____________。
(2)经测定发现,N2O5固体由NO2+和NO3-同种离子组成,该固体中N原子杂化类型为_____;与NO2+互为等电子体的微粒有______(写出一种)。
(3)铵盐大多不稳定。NH4F、NH4I中,较易分解的是______,原因是____________。
(4)第二周期中,第一电离能介于B元素和N元素间的元素为_______(填元素符号)
(5)已知NiO的晶体结构如图所示。
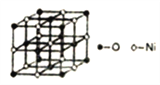
①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO晶体中镍原子填充在氧原子形成的____体空隙中。
②已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm,则熔点MgO______NiO(填“>”、“<”或“=”),理由是___________。
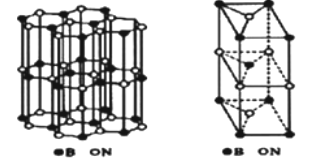
(6)硼和氮构成的一种氮化硼晶体的结构与石墨晶体结构相类似B、N原子相互交替排列如图左下图,其晶胞结构如右下图所示。设层内B-N核间距为apm,面间距为bpm,则该氮化硼晶体的密度为_______g/cm3(用含a、b、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】市场销售的某种精制食用盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+KI+H2SO4=K2SO4+I2+H2O,______________
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应后溶液显酸性,写出该反应的离子方程式:_____________________________。
②某同学设计回收四氯化碳的操作步骤如下,请将缺少的操作步骤补充完整。
a.将碘的四氯化碳溶液置于分液漏斗中; b.加入适量Na2SO3溶液
c.____________________ d.分离出下层液体。
(3)已知:I2+2S2O32=2I-+S4O62-。某质量检验监督局测定食用精制盐的碘含量,其步骤为:
a.准确称取12.7g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,以6.0×10-4mol·L-1的Na2S2O3标准溶液滴定,消耗20.00mL标准液。
①判断c中滴定反应恰好完全的现象是_____________________。
②根据以上实验和包装袋说明,所测精制盐的碘含量是____mg/kg。
(4)用惰性电极电解KI溶液可制备碘酸钾,则阳极反应式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com