
【题目】在室温下,向Cu(IO3)2饱和溶液中加入足量的经稀硫酸酸化的KI溶液,产生碘化亚铜(CuI)沉淀,溶液由蓝色变为棕黄色,反应前加入淀粉溶液不变蓝,反应后加入淀粉溶液变为蓝色.
(1)该反应中氧化剂是;
(2)该反应的氧化产物是;
(3)1mol氧化剂在反应中得到电子的物质的量为;
(4)某反应体系中有物质:Bi2(SO4)3、NaMnO4、H2O、MnSO4、NaBiO3、Na2SO4、H2SO4 . 请将NaBiO3之外的反应物与生成物分别填入以下空格内,配平化学计量数,并用单线桥表示电子转移的方向和数目. ![]()
【答案】
(1)Cu(IO3)2
(2)I2
(3)11mol
(4)10NaBiO3+4MnSO4+14H2SO4=5Bi2(SO4)3+4NaMnO4+3Na2SO4+14H2O;

【解析】解:(1)向Cu(IO3)2饱和溶液中加入足量的经稀硫酸酸化的KI溶液,产生CuI沉淀,溶液由蓝色变为棕黄色,反应前加入淀粉溶液不变蓝,反应后加入淀粉溶液变为蓝色,则反应过程中有碘生成,同时说明铜离子、碘酸根离子得电子发生还原反应,则Cu(IO3)2作氧化剂,碘化钾中碘离子失电子作还原剂,故答案为:Cu(IO3)2; (2)还原剂碘离子失电子对应的产物I2是氧化产物,故答案为:I2;(3)根据氧化剂和转移电子之间的关系式得转移电子的物质的量=1mol×[(2﹣1)+(5﹣0)×2]=11mol;(4)该反应中NaBiO3是反应物,根据Bi元素守恒,Bi2(SO4)3是生成物,Bi元素由反应物到生成物,化合价降低,所以NaBiO3是氧化剂;NaMnO4中锰元素的化合价是+7价,MnSO4中锰元素的化合价是+2价,要选取还原剂,只能是化合价由低变高,所以MnSO4作还原剂,NaMnO4是氧化产物;再根据元素守恒,反应物中还有硫酸,产物中还有Na2SO4和H2O;该反应中,NaBiO3是氧化剂,MnSO4作还原剂;MnSO4→NaMnO4 , 锰元素由+2价→+7价,一个MnSO4失去5个电子;
NaBiO3→Bi2(SO4)3 , Bi元素由+5价→+3价,生成一个Bi2(SO4)3 , 需得4个电子,所以其得失电子的最小公倍数为20,则其化学反应方程式为10NaBiO3+4MnSO4+14H2SO4=5Bi2(SO4)3+4NaMnO4+3Na2SO4+14H2O.故答案为:10NaBiO3+4MnSO4+14H2SO4=5Bi2(SO4)3+4NaMnO4+3Na2SO4+14H2O; .
.
(1)得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂;(2)还原剂对应的产物是氧化产物;(3)根据氧化剂和转移电子之间的关系式计算;(4)根据化合价的升降判断参加氧化还原反应的反应物和生成物,然后根据元素守恒判断未参加氧化还原反应的反应物和生成物;根据化合价 的升降判断电子的转移方向,根据得失电子的最小公倍数确定转移的电子数.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)室温下,0.1 mol/L的下列溶液中,①NH4Al(SO4)2 ②NH4HSO4 ③HCl ④(NH4)2SO4 ⑤NH4Cl ⑥NH4HCO3 ,pH由大到小的顺序为__________(填写序号)
(2)加热,逐渐蒸干FeSO4溶液,得到的物质为___________。(填化学式)
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图象。

①其中符合0.1 mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线是_____(填写罗马数字)
②25 ℃时,0.1 mol/L的NH4Al(SO4)2溶液中2c(![]() )-c(
)-c(![]() )-3c(Al3+)=____(填数值)。
)-3c(Al3+)=____(填数值)。
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是____;在b点,溶液中各离子浓度由大到小的排列顺序是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,物质的量最大的是 , 摩尔质量最大的是 , 标准状况下体积最大的是 , 含氢原子个数最多的是 , 质量最大的是 . A.6gH2 B.0.8mol CH4 C.1.204×1024个H2S分子 D.147g H3PO4E.27mL水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量CO2通入KOH和Ca(OH)2的混合溶液中,生成沉淀的质量(m)和通入CO2体积(V)的关系如图所示: 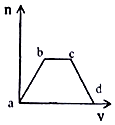
(1)ab段发生的离子反应方程式为 .
(2)bc段依次发生两个离子反应,首先是 , 其次是 .
(3)cd段发生的离子反应方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,反应A2(g)+B2(g)![]() xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间) ( )
xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间) ( )

A. P3<P4,y为A2转化率
B. P3<P4,y为A2浓度
C. P3>P4,y为混合气密度
D. P3>P4,y为C的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合题。
(1)在同温、同压下,实验测得CO,N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为 . 若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为 .
(2)相同条件下,某Cl2与O2混合气体100mL恰好与150mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为 , 混合气体的平均相对分子质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH = -92.2kJmol—1,测得0到10秒内,c(H2)减小了0.75molL—1,下列说法正确的是
2NH3(g) ΔH = -92.2kJmol—1,测得0到10秒内,c(H2)减小了0.75molL—1,下列说法正确的是
A.10到15秒内c(NH3) 增加量等于0.25mol L—1
B.化学反应速率关系是:3υ正(H2)= 2υ正(NH3)
C.达平衡后,分离出少量NH3,V正 增大
D.该反应的逆反应的活化能不小于92.2kJmol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组为探究ClO﹣、I2、SO ![]() 在酸性条件下的氧化性强弱,已知I2遇淀粉变蓝,设计实验如下: 实验①:在淀粉KI溶液中加入少量NaClO溶液,并加入少量的稀H2SO4 , 溶液立即变蓝;
在酸性条件下的氧化性强弱,已知I2遇淀粉变蓝,设计实验如下: 实验①:在淀粉KI溶液中加入少量NaClO溶液,并加入少量的稀H2SO4 , 溶液立即变蓝;
实验②:向实验①的溶液中加入4L 0.5mol/L的Na2SO3溶液,发生反应如下
SO ![]() +I2+H2O→SO
+I2+H2O→SO ![]() +I﹣+H+(未配平),恰好完全反应.
+I﹣+H+(未配平),恰好完全反应.
(1)以上实验说明,在酸性条件下ClO﹣、I2、SO42﹣的氧化性由弱到强的顺序是 .
(2)实验②中化学反应转移电子的物质的量是 .
(3)写出实验①中发生反应的离子方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com