
【题目】二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚( CH3OCH3)。请回答下列问题:
(1)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)![]() CH3OH(g) △H= -90.8kJ/mol
CH3OH(g) △H= -90.8kJ/mol
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.3kJ/mol
CO2(g)+H2(g) △H=-41.3kJ/mol
总反应:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g) 的△H= ;
CH3OCH3(g)+CO2(g) 的△H= ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是:________(填字母代号)。
a.压缩体积 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度e.分离出二甲醚(CH3OCH3)
(2)已知反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度(mol·L-1) | 0.40 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小比较:![]() _________
_________![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②该反应的平衡常数的表达式为K=_____,温度升高,该反应的平衡常数K____(填“增大”、“减小”或“不变”)
【答案】(1)-246.4 kJ/mol a c e(2) ①> ②{c(CH3OCH3)×c(H2O)} /c2(CH3OH) 减小
【解析】
(1)①×2+②+③可得总反应:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g) △H=2×(-90.8kJ/mol)+(-23.5kJ/mol)+(-41.3kJ/mol)=-246.4 kJ/mol。
CH3OCH3(g)+CO2(g) △H=2×(-90.8kJ/mol)+(-23.5kJ/mol)+(-41.3kJ/mol)=-246.4 kJ/mol。
(2)若a压缩体积,体系的压强增大,化学平衡向正反应方向移动,反应物的转化率提高;b加入催化剂能同等倍数改变正、逆反应的化学反应速率,缩短达到平衡所需时间,平衡不移动;c减少CO2的浓度,平衡向正反应方向移动,反应物的转化率提高;d.增加CO的浓度,平衡向正反应方向移动,但增加量远远大于平衡移动消耗量,所以CO的转化率反而降低。e.分离出二甲醚(CH3OCH3)即减小生成物的浓度,化学平衡向正反应方向移动,反应物的转化率提高。故在该总反应中,要提高CO的转化率的途径是ace.
(2)①比较浓度商(即各生成物浓度幂指数乘积与反应物浓度幂指数乘积的比)与K 大小。如果比K大,平衡向逆反应方向移动,V逆>V正;如果比K小,平衡向正反应方向移动, V正>V逆;如果等于K,平衡不会发生移动, V正=V逆;由于(0.6×0.6)/(0.4)2==9/4<400,所以平衡向正反应方向移动,V正>V逆。
②化学平衡常数是反应达到化学平衡时各生成物浓度幂指数的乘积与各反应物浓度幂指数的乘积的比即K={c(CH3OCH3)×c(H2O)} /c2(CH3OH).该反应的正反应是放热反应,升高温度,根据勒夏特列原理,化学平衡向逆反应方向移动,生成物的浓度减小,反应物的浓度增大,对化学平衡常数来说,分子减小,分母扩大,所以K减小。


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是______。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)______。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为______。
②完成NaClO3氧化FeCl2的离子方程式:
___![]() +___Fe2++___=___Cl+___Fe3++__
+___Fe2++___=___Cl+___Fe3++__
(3)FeCl3在溶液中分三步水解:
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]()
![]() +H+ K2
+H+ K2
![]() +H2O
+H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是__________。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)______。
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)______。
a.降温 b.加水稀释
c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是___。
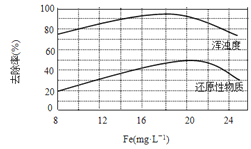
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为_____mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上且不会因为过热而造成安全风险。如图是氟离子电池工作示意图,其中充电时F-从乙电极流向甲电极,下列关于该电池的说法正确的是( )

A.放电时,甲电极的电极反应式为Bi-3e-+3F-=BiF3
B.放电时,乙电极电势比甲电极高
C.充电时,导线上每通过1mole-,甲电极质量增加19g
D.充电时,外加电源的正极与乙电极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g)![]() 2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )
2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A. ①④⑥B. ②③⑤C. ①③④D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_________,烧杯间填满碎塑料泡沫的作用是______.
(2)大烧杯上如不盖硬纸板,则求得的中和热数值______________(填“偏大”、“偏小’、“无影响”)
(3)实验中改用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热的数值______(填“相等”或“不相等”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:3X(g)+Y(g) ![]() 2Z(g)+2W(g)在2 L密闭容器中进行,5 min后Y减少了0.5 mol,则此反应的反应速率为( )
2Z(g)+2W(g)在2 L密闭容器中进行,5 min后Y减少了0.5 mol,则此反应的反应速率为( )
A.v(X)=0.05 mol·L-1·min-1B.v(Y)=0.10 mol·L-1·min-1
C.v(Z)=0.10 mol·L-1·min-1D.v(W)=0.10 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
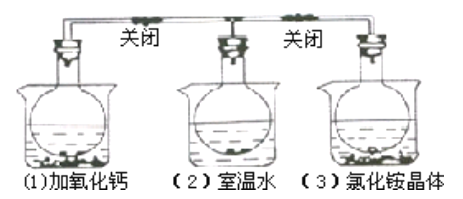
【题目】三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中 加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1))中红棕色变深,(3)中红棕色变浅,下列叙述正确的是( )
A. 2NO2![]() N2O4是放热反应
N2O4是放热反应
B. NH4Cl溶于水时放出热量
C. 烧瓶(1)中平衡混合气的平均相对分子质量增大
D. 烧瓶(3)中气体的压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】屈昔多巴( ![]() )是一种抗帕金森氏病药物。以下是屈昔多巴的一种合成路线(
)是一种抗帕金森氏病药物。以下是屈昔多巴的一种合成路线( ![]() 简写为BnCl,
简写为BnCl, ![]() 简写为CbzCl ):
简写为CbzCl ):

回答下列问题:
(1)反应①的反应类型为_________,其作用为_____________。
(2)屈昔多巴中所含的非含氧官能团名称为_______________,屈昔多巴分子中有_____个手性碳原子。
(3)反应②为加成反应,则有机物X的名称为________________。
(4)![]() 显________性(填“酸”、“中”或“碱”)。
显________性(填“酸”、“中”或“碱”)。
(5)![]() 的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有_____种,其中核磁共振氢谱为四组峰的结构简式为___________________________。
的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有_____种,其中核磁共振氢谱为四组峰的结构简式为___________________________。
(6)参照上述合成路线,以对羟基苯甲醛为原料(无机试剂任选),设计制备对羟基苯甲酸的合成路线: __________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com