
【题目】某工厂排放出有毒物质NOCl,它遇水就会生成NO3-,NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为______。水源中的NO3-对人类健康会产生危害。为了降低水源中NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为______。
【答案】![]() 10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O
10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O
【解析】
NOCl分子中各原子均满足8电子稳定结构,则氮原子与氧原子共用2对电子,与氯原子共用1对电子;根据题干信息,反应物为:铝、NO3-、OH-,生成物为:N2、H2O、AlO2-,根据电子守恒和原子守恒书写方程式并计算即可。
NOCl分子中各原子均满足8电子稳定结构,则氮原子与氧原子共用2对电子,与氯原子共用1对电子,电子式为:![]() ;
;
根据题干信息,反应物为:铝、NO3-、OH-,生成物为:N2、H2O、AlO2-,反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2,氮元素化合价由+5价降低为0价,生成1个N2共降低10价,化合价升、降最小公倍数为30,则Al、AlO2-的系数是10,NO3-的系数是6,N2的系数是是3,根据电荷守恒,可知OH-的系数是4,最后根据原子守恒可知H2O的系数是2反应的离子方程式:10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O。


科目:高中化学 来源: 题型:
【题目】汽车尾气(含烃类、CO、NO和SO2等)是空气的主要污染源。治理方法之一是在汽车排气管上加装“催化转化器”,使CO和NO反应产生可参与大气循环的无毒气体,促使烃类充分燃烧及SO2的转化。下列说法中错误的是
A. CO和NO反应生成CO2和N2:2CO+2NO![]() 2CO2+N2
2CO2+N2
B. 汽车改用天然气为燃料或开发氢能源,都可减少对空气的污染
C. 此方法的缺点是由于CO2的增多,会大大提高空气的酸度
D. 增大绿化面积,多植树造林,可有效控制城市空气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在新型钴基电催化剂作用下,用石墨、铁做电极材料,可将CO2和水转化为甲酸。其反应原理如图所示,下列说法不正确的是( )
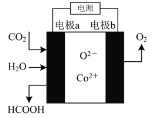
A.电极a为铁,与电源的负极相连
B.反应时化学能转化成电能
C.电极a上发生的反应为:CO2+2e-+2H2O=HCOOH+O2-
D.反应时,O2-向阳极处移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验探究小组进行如下实验,探究化学反应中的能量变化。
实验① | 实验② |
|
|
温度计读数升高 | 温度计读数降低 |
下列判断一定正确的是( )
A.实验①的反应中化学键断裂吸收的能量大于实验②
B.实验①的反应中化学键断裂吸收的能量小于实验②的反应中化学键形成放出的能量
C.实验①说明中和反应放出热量
D.实验②说明所有有氨气生成的反应均吸收热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaBiO3固体(黄色,微溶)加入到MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的离子方程式:
________NaBiO3+________Mn2++________________![]() ________Na++________Bi3++_______________+______________。
________Na++________Bi3++_______________+______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 晶体的晶胞结构与NaCl晶体的相似
晶体的晶胞结构与NaCl晶体的相似![]() 如图所示
如图所示![]() ,但因为
,但因为![]() 晶体中含有的哑铃形
晶体中含有的哑铃形![]() 的存在,使晶胞沿一个方向拉长。下列关于
的存在,使晶胞沿一个方向拉长。下列关于![]() 晶体的说法中正确的是
晶体的说法中正确的是![]()

A. 1个![]() 周围距离最近且等距离的
周围距离最近且等距离的![]() 数目为4
数目为4
B. 该晶体中的阴离子和O2是等电子体
C. ![]() 克
克![]() 晶体中含阴离子0.2mol
晶体中含阴离子0.2mol
D. 与每个![]() 距离相等且最近的
距离相等且最近的![]() 共有12个
共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:K=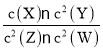 ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )
A.升高温度,平衡常数K增大
B.升高温度,若混合气体的平均相对分子质量变小,则正反应是放热反应
C.增大压强,W(g)体积分数增加
D.增大X(g)浓度,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种天然气臭味添加剂的绿色合成方法为:CH3CH2CH=CH2+H2S ![]() CH3CH2CH2CH2SH。下列反应的原子利用率与上述反应相近的是
CH3CH2CH2CH2SH。下列反应的原子利用率与上述反应相近的是
A. 乙烯与水反应制备乙醇
B. 苯和硝酸反应制备硝基苯
C. 乙酸与乙醇反应制备乙酸乙酯
D. 甲烷与Cl2反应制备一氯甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)反应①的化学平衡常数K的表达式为___;图1中能正确反映平衡常数K随温度变化关系的曲线为___(填曲线标记字母),其判断理由是___。
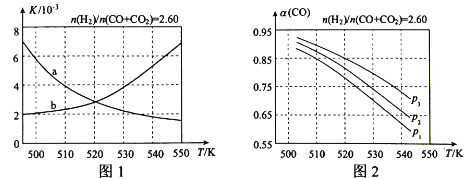
(2)合成气的组成![]() =2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而___(填“增大”或“减小”),其原因是___。图2中的压强由大到小为___,其判断理由是___。
=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而___(填“增大”或“减小”),其原因是___。图2中的压强由大到小为___,其判断理由是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com