
【题目】将NaBiO3固体(黄色,微溶)加入到MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的离子方程式:
________NaBiO3+________Mn2++________________![]() ________Na++________Bi3++_______________+______________。
________Na++________Bi3++_______________+______________。
【答案】5 2 14 H+ 5 5 2 MnO4- 7 H2O
【解析】
MnO4-的水溶液显紫色,在酸性条件下NaBiO3被MnSO4还原为Bi3+,Mn2+被氧化为紫色的MnO4-,同时产生水,根据电子守恒、电荷守恒、原子守恒,书写方程式。
在该反应中,Bi元素化合价由反应前NaBiO3中的+5价变为反应后Bi3+的+3价,降低了2价,Mn元素化合价也由反应前+2价的Mn2+被氧化为+7价的MnO4-,化合价升高了5价,根据元素化合价升降总数相等,可知NaBiO3、Bi3+的系数是5;Mn2+、MnO4-的系数是2,根据Na守恒,可知Na+的系数是5,根据电荷守恒,可知H+的系数是14,结合原子守恒,可知反应产生的H2O的系数是7,反应的离子方程式为:5NaBiO3+2Mn2++14H+=5Na++5Bi3++2MnO4-+7H2O。


科目:高中化学 来源: 题型:
【题目】A 是石油裂解气的主要成分之一,以 A 为原料制备药物中间体 X 的合成路线如下:

已知: i 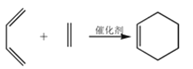 ii
ii ![]()
回答下列问题:
(1)D 中含碳原子的官能团的结构简式为_____。
(2)有机物 I 的结构简式为_____;反应④的反应类型是________。
(3)反应⑥的化学方程式为_____。
(4)根据已知条件写出 CH2=CH—CH=CH2 与有机物 G 的化学反应方程式_____; 该产物发生反应③后得到的有机物其核磁共振氢谱中有_____组峰。
(5)满足以下条件的 I 的同分异构体有_____种。
i 官能团的类型与 I 不同; ii 含有六元环结构; iii 六元环上只有 1 个取代基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知![]() 能发生如下反应
能发生如下反应
_______NaNO2+_____HI——_________NO↑+_________I2+_______NaI+____H2O
(1)配平上面方程式。
(2)若有1 mol的氧化剂被还原,则被氧化的还原剂是 ________mol。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋,进行实验,下列选项合适的是_____(填字母)。
A.①②④ B.③⑤ C. ①②③⑤ D.①②⑤
(4)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,采用NH4Cl,能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 按系统命名法,化合物![]() 的名称为2-2-二甲基己烷
的名称为2-2-二甲基己烷
B. 等质量的聚乙烯、甲烷、乙炔分别充分燃烧,所耗氧气的量依次减少
C. 用酒精消毒,其原理是酒精使细菌中的蛋白质变性而失去生理活性
D. 蔗糖、麦芽糖和乳糖的分子式都为C12H22O11,均能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①在25 ℃条件下将pH=12的氨水稀释过程中,下列关系式正确的是________。
A.能使溶液中c(NH4+)·c(OH-)增大
B.溶液中c(H+)·c(OH-)不变
C.能使溶液中![]() 比值增大
比值增大
D.此过程中Kw增大
②在25 ℃条件下将pH=12的氨水稀释100倍后溶液的pH为________(填序号)。
A.10 B.11 C.10~12 D.11~13
(2)25 ℃时,向0.1 mol·L-1的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是________(填序号)。
①氨水与氯化铵发生化学反应
②氯化铵溶液水解显酸性,增加了c(H+)
③氯化铵溶于水,电离出大量铵离子,抑制了一水合氨的电离,使c(OH-)减小
(3)室温下,如果将0.2 mol NH4Cl和0.1 mol NaOH全部溶于水,形成混合溶液(假设无损失)。
①________和________两种粒子的物质的量之和等于0.2 mol。
②________和________两种粒子的物质的量之和比OH-多0.1 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排放出有毒物质NOCl,它遇水就会生成NO3-,NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为______。水源中的NO3-对人类健康会产生危害。为了降低水源中NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(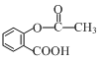 )是应用广泛的解热镇痛药,通过乙二醇将阿司匹林连接在高聚物E上,可制得缓释长效阿司匹林,其合成路线如图(部分反应条件已略去):
)是应用广泛的解热镇痛药,通过乙二醇将阿司匹林连接在高聚物E上,可制得缓释长效阿司匹林,其合成路线如图(部分反应条件已略去):
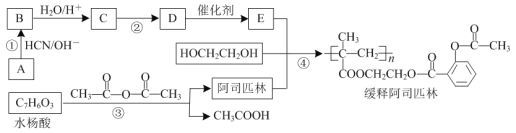
已知:CH3CHO![]()
回答下列问题:
(1)反应①的反应类型是___。
(2)反应②的化学方程式为___。
(3)写出同时满足下列条件的阿司匹林的一种同分异构体的结构简式:___。
Ⅰ.属于芳香族化合物,能与NaHCO3溶液反应;
Ⅱ.能发生水解反应,酸性条件下水解所得有机物中均含有两种不同化学环境的氢。
(4)写出以![]() 为原料制备药物中间体Y(
为原料制备药物中间体Y(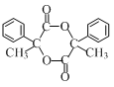 )的合成路线流程图___(无机试剂任用,合成路线流程图示例见本题题干)。
)的合成路线流程图___(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F可通过如下路线合成得到:
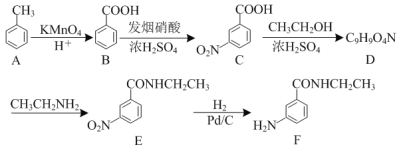
(1)F中的含氧官能团的名称为___。D→E的反应类型为___。
(2)写出D的结构简式:___。
(3)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___。
①含苯环,既能发生银镜反应、也能发生水解反应;
②是一种α-氨基酸,分子中含6种不同化学环境的氢。
(4)已知:苯胺(![]() )有弱碱性、易被氧化。写出以
)有弱碱性、易被氧化。写出以![]() 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备 的合成路线流程图___(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图___(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.18gT2O(3H2O)中,含有的电子总数为10NA
B.5.6g铁与足量的水蒸气在高温条件下反应,转移电子数是0.3NA
C.标准状况下,4.48LCH3Cl中所含原子总数为NA
D.1molSO2与2molO2在一定条件下充分反应,生成SO3的分子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com