
����Ŀ���л���A��һ����Ҫ�Ļ���ԭ�ϣ���AΪ��Ҫ��ʼԭ�ϣ�ͨ������;�����Ժϳɸ߷��Ӳ���PA��PC��

�Իش���������
��1��B�Ļ�ѧ����Ϊ_____________��B��C�ķ�Ӧ������_____________��
��2��E��F�ķ�Ӧ����Ϊ_____________���߷��Ӳ���PA�Ľṹ��ʽΪ_____________��
��3����A����H�Ļ�ѧ����ʽΪ_______________________________________��
��4��ʵ���Ҽ����л���A����ѡ���Լ�_____________��_____________��
��5��E��ͬ���칹�У�������̼��������Һ��Ӧ���ܷ���������Ӧ���л��ﹲ��_____________�֡����к˴Ź�������ͼ��5��壬�ҷ����֮��Ϊ6��1��1��1��1�����ʵĽṹ��ʽΪ_____________��
��6����Bͨ��������Ӧ�Ʊ�1��3��������ϩ�ĺϳ�·��Ϊ_____________��
���𰸡������� Ũ���ᡢ���� ������Ӧ 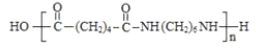
![]() ��Һ Ũ��ˮ 12
��Һ Ũ��ˮ 12 ![]()
![]()
��������
��PC�Ľṹ��ʽΪ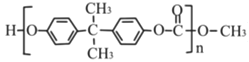 ���������Ʒ���֪��H�Ľṹ��ʽ��
���������Ʒ���֪��H�Ľṹ��ʽ��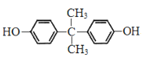 ��A���ͪ��Ӧ����
��A���ͪ��Ӧ���� ����֪A��
����֪A��![]() ��
��![]() �����������ӳɷ�Ӧ����
�����������ӳɷ�Ӧ����![]() ����BΪ
����BΪ![]() ��
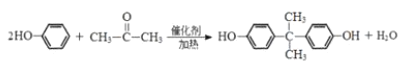
��![]() ��Ũ���������������¹��ȷ�����ȥ��Ӧ����
��Ũ���������������¹��ȷ�����ȥ��Ӧ����![]() ����C��
����C��![]() ��
��![]() ��˫��ˮ����������Ӧ����
��˫��ˮ����������Ӧ����![]() ����ͭ�����������£�
����ͭ�����������£�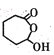 ������������Ӧ����
������������Ӧ����![]() ����FΪ
����FΪ![]() ��
��![]() ����ˮ�ⷴӦ����
����ˮ�ⷴӦ����![]() ���ڴ��������£�
���ڴ��������£�![]() �뼺�����������۷�Ӧ����
�뼺�����������۷�Ӧ����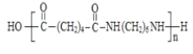 ����PAΪ
����PAΪ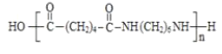 ��
��
��1���ɷ�����֪��B�Ľṹ��ʽ��![]() ������Ϊ��������B��C�ķ�Ӧ��
������Ϊ��������B��C�ķ�Ӧ��![]() ��Ũ���������������¹��ȷ�����ȥ��Ӧ����
��Ũ���������������¹��ȷ�����ȥ��Ӧ����![]() ���ʴ�Ϊ����������Ũ���ᡢ���ȣ�
���ʴ�Ϊ����������Ũ���ᡢ���ȣ�
��2��E��F�ķ�ӦΪ��ͭ�����������£� ������������Ӧ����
������������Ӧ����![]() ���ɷ�����֪PA�Ľṹ��ʽΪ
���ɷ�����֪PA�Ľṹ��ʽΪ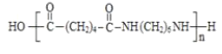 ���ʴ�Ϊ��������Ӧ��PAΪ
���ʴ�Ϊ��������Ӧ��PAΪ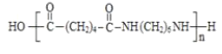 ��
��
��3��A����H��ӦΪ![]() ���ͪ�����ӳɷ�Ӧ����
���ͪ�����ӳɷ�Ӧ���� ����Ӧ�Ļ�ѧ����ʽΪ
����Ӧ�Ļ�ѧ����ʽΪ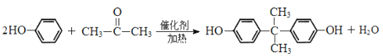 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
(4)A�DZ��ӣ�������FeCl3��Һ����ɫ��������Ũ��ˮ��Ӧ���ɰ�ɫ����2,4,6-���屽�ӣ�����ʵ���Ҽ��鱽�ӣ���ѡ��FeCl3��Һ��Ũ��ˮ���ʴ�Ϊ��FeCl3��Һ��Ũ��ˮ��
(5)����̼��������Һ��Ӧ˵�������Ȼ����ܷ���������Ӧ˵������ȩ���� ����ȩ�����Ȼ���ͬ���칹����
����ȩ�����Ȼ���ͬ���칹����![]() ��
��![]() ��
��![]() ��
��![]() ��
��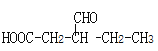 ��
��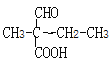 ��
��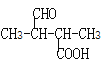 ��
��![]() ��
��![]() ��
��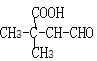 ��
��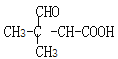 ��
��![]() ����12�֣����к˴Ź�����гͼ��5��壬�ҷ����֮��Ϊ6��1��1��1��1�����ʵĽṹ��ʽΪ
����12�֣����к˴Ź�����гͼ��5��壬�ҷ����֮��Ϊ6��1��1��1��1�����ʵĽṹ��ʽΪ![]() ���ʴ�Ϊ��12��
���ʴ�Ϊ��12��![]() ��
��
(6)��![]() ��
��![]() �ṹ��ʽ��֪���������Ʒ��ϳ�
�ṹ��ʽ��֪���������Ʒ��ϳ�![]() �IJ���Ϊ��������Ũ���������·�����ȥ��Ӧ���ɻ���ϩ������ϩ����ˮ�����ӳɷ�Ӧ����1,2-���廷���飬1,2-���廷�������������ƵĴ���Һ�м��ȷ�����ȥ��Ӧ����1��3��������ϩ����ϳ�·��Ϊ
�IJ���Ϊ��������Ũ���������·�����ȥ��Ӧ���ɻ���ϩ������ϩ����ˮ�����ӳɷ�Ӧ����1,2-���廷���飬1,2-���廷�������������ƵĴ���Һ�м��ȷ�����ȥ��Ӧ����1��3��������ϩ����ϳ�·��Ϊ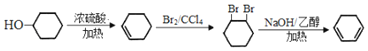 ���ʴ�Ϊ��
���ʴ�Ϊ��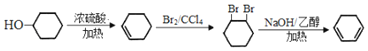 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���о����֣����ᷢ��������ԭ��Ӧʱ�������Ũ��Խϡ����Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�͡�����һ�����������Ͻ����ϡ�������ַ�Ӧ����Ӧ������������ų����ڷ�Ӧ���������Һx�У���μ���4molL��1������������Һ����������������Һ�������mL��������ij��������ʵ�����mol���Ĺ�ϵ��ͼ��ʾ���������йؼ�����ж���ȷ���ǣ�������
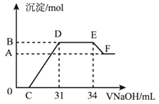
A.��Һx���������������У�Al3+��H+��Fe3+��Fe2+
B.��DE�Σ�������Ӧ�����ӷ���ʽΪNH4++OH����NH3H2O
C.�����B���Ӧ�ij��������ʵ���
D.C���Ӧ������������Һ�����Ϊ7mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽ̽�����ں���a g HNO3��ϡ�����У�����b g���۳�ַ�Ӧ����ȫ���ܽⲢ����NO����a/4 g HNO3����ԭ����a��b������Ϊ (����)
A. 2��1 B. 3��1 C. 4��1 D. 9��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��a��b��c��d��e��f��gΪ�����ɶ�����Ԫ�ع��ɵ����ӣ����Ƕ���10�����ӣ���ṹ�ص�������ʾ��(��λ�����)
���Ӵ��� | a | b | c | d | e | f | g |
����� | 0 | ��1 | ��1 | 0 | ��2 | ��1 | 0 |
����b�����Ӱ뾶����e�����Ӱ뾶��c��f���γ�����������g���ӡ���д����
(1)a���ӵ�ԭ�ӽṹʾ��ͼ��______________��
(2)b��e��ӦԪ�ص�����������Ӧˮ����ļ���ǿ���Ƚ�Ϊ________(�û�ѧʽ��ʾ)��
(3)��d��������ˮ����ˮ��Һ�б仯�ķ���ʽΪ________��ʵ�����Ʊ�d����Ļ�ѧ����ʽΪ________����dΪ���������η��ӣ�����ҪӦ��֮һΪ________��
(4)c������________��f������________(�û�ѧʽ��ʾ)����c��f����g�����ӷ���ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��AA705�Ͻ�(��![]() ��
��![]() )�������һ����̣���������Ϊ�ֵ�����֮һ���ѱ����ڷɻ������ͻ����������ֻ�����ϵȡ��ش��������⣺
)�������һ����̣���������Ϊ�ֵ�����֮һ���ѱ����ڷɻ������ͻ����������ֻ�����ϵȡ��ش��������⣺
��1��![]() ��
��![]() �������ӻ�̬��������Ų�ʽΪ_____________________��
�������ӻ�̬��������Ų�ʽΪ_____________________��![]() ����Ԫ�صĵ�һ�������ɴ�СΪ_____________________��
����Ԫ�صĵ�һ�������ɴ�СΪ_____________________��
��2����![]() �Ϳ���Ѫ��Ϊԭ�ϣ����Ʊ�
�Ϳ���Ѫ��Ϊԭ�ϣ����Ʊ�![]() ������Ѫ��ķ��ӽṹ��ͼ1��ʾ��������̼ԭ�ӵĹ���ӻ�����Ϊ_______________���Ʋ⿹��Ѫ����ˮ�е��ܽ��ԣ�_______________���������ˮ����������ˮ������һ��
������Ѫ��ķ��ӽṹ��ͼ1��ʾ��������̼ԭ�ӵĹ���ӻ�����Ϊ_______________���Ʋ⿹��Ѫ����ˮ�е��ܽ��ԣ�_______________���������ˮ����������ˮ������һ��![]() ��������ͼ2���У�
��������ͼ2���У�![]() ԭ�ӵ���ĿΪ_______________��
ԭ�ӵ���ĿΪ_______________��
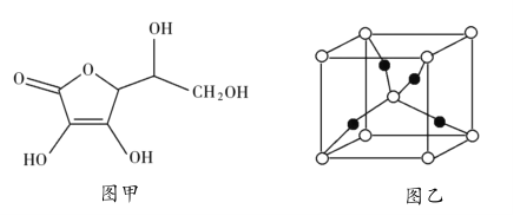
��3��![]() ��
��![]() �����嶼����
�����嶼����![]() �γ������ӡ�
�γ������ӡ�![]() ��______
��______![]() �����������ӵ���λ��Ϊ______________��
�����������ӵ���λ��Ϊ______________��
��4��![]() ��ɱ��Ч�ʸߡ������ö����㷺Ӧ�á���֪
��ɱ��Ч�ʸߡ������ö����㷺Ӧ�á���֪![]() ���۵�Ϊ2000�棬�侧���ṹ��ͼ��ʾ��
���۵�Ϊ2000�棬�侧���ṹ��ͼ��ʾ��
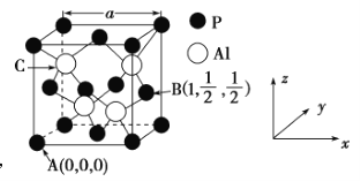
�������ľ�������Ϊ______________��
��A��B���ԭ��������ͼ��ʾ����C���ԭ������Ϊ___________��
�������ľ�������![]() �����ܶ�Ϊ____________
�����ܶ�Ϊ____________![]() (�г�����ʽ���ɣ���
(�г�����ʽ���ɣ���![]() ��ʾ�����ӵ�������ֵ)��
��ʾ�����ӵ�������ֵ)��
��5��![]() ���жԳƵ����幹�ͣ�
���жԳƵ����幹�ͣ�![]() �е�����
�����![]() ������
������![]() ȡ�����ܵõ����ֲ�ͬ�ṹ�IJ����
ȡ�����ܵõ����ֲ�ͬ�ṹ�IJ����![]() �Ŀռ乹��Ϊ________________��
�Ŀռ乹��Ϊ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����������ʵ�������ȷ����(����)
A.SiO2��Ũ�����ڸ������ܷ�Ӧ����SiCl4
B.ľ̿��Ũ���Ṳ�ȿ�����CO2
C.������Һ�м������NaOH��Һ���Ʊ�Al(OH)3����
D.��ʳ��ˮ��ͨ������CO2���Ƶ�NaHCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����(����)
A.�����£�pH��3��CH3COOH��Һ��pH��11��NaOH��Һ�������ϣ�������ҺpH>7
B.�����£�Na2CO3��Һ�м�������Ca(OH)2���壬��Һ��![]() ��ֵ����
��ֵ����
C.����ӵ����������������У��뽫�������ĸ����豸��ֱ����Դ�ĸ�������
D.��ӦNH3(g)��HCl(g)=NH4Cl(s)�����������Է����У��÷�Ӧ����H>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���м�����λͬѧ��������ԭ��ط�Ӧ�������Ļ��˳�����˾�ʹ��þƬ����Ƭ���缫������ͬѧ���缫���� 6mol/L ��������Һ����ͬѧ���缫���� 6mol/L ������������Һ�У���ͼ��ʾ��
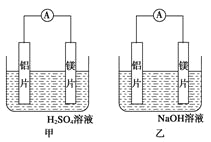
��1��д������������ĵ缫��Ӧʽ___________________ ��
��2��д���ҳ��и����ĵ缫��Ӧʽ�� ������_____ �ܷ�Ӧ�����ӷ���ʽ��_________
��3�����������ͬѧ����Ϊ������ԭ��صĵ缫����������ǽ� �����ɸ������ϵĽ�������
������жϳ�_____��Ը�ǿ�����һ��жϳ�_____��Ը�ǿ�������ƣ�
��4���ɴ�ʵ�飬�ɵõ�������Щ��ȷ������_____��
a. ����ԭ��ط�Ӧ�жϽ������˳��ʱӦע��ѡ����ʵĽ���
b. þ�Ľ����Բ�һ��������ǿ
c. ��ʵ��˵���������˳����ѹ�ʱ����û�����ü�ֵ
d. ��ʵ��˵����ѧ�о������ӣ���Ӧ������Ӱ��ϴ����Ӧ��������������
��5������ʵ��Ҳ������֤������ֱ�����ý������˳����ж�ԭ����е�����������������__�� ���ɿ����������ɿ��������粻�ɿ������������һ���ж�ԭ����������Ŀ���ʵ�鷽��_______________ ���� �ɿ����ɲ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ˮ����Ҫ���ӵĺ������±������������������������е���������ԭ����ͼ��ʾ(����Ϊ���Ե缫����Ĥֻ����������ͨ������Ĥֻ����������ͨ��)�������й�˵���������( )
���� |
|
|
|
|
|
|
|
���� | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
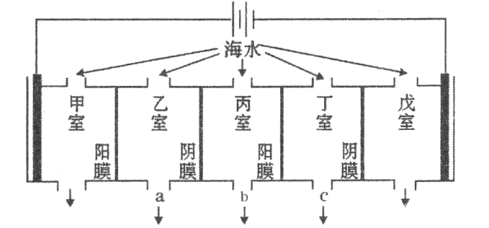
A.���ҵĵ缫��ӦʽΪ��![]()
B.���ҺͶ����в������ӵ�Ũ������ˮ�ij���Ϊb
C.�������ռ���![]() (��״��)����ʱ��ͨ��������Ĥ�����ӵ����ʵ���һ��Ϊ
(��״��)����ʱ��ͨ��������Ĥ�����ӵ����ʵ���һ��Ϊ![]()
D.�������������������γ�ˮ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com