
【题目】某海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )
离子 |
|
|
|
|
|
|
|
含量 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
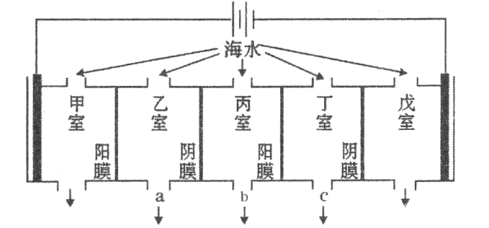
A.甲室的电极反应式为:![]()
B.乙室和丁室中部分离子的浓度增大,淡水的出口为b
C.当戊室收集到![]() (标准状况)气体时,通过甲室阳膜的离子的物质的量一定为
(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为![]()
D.淡化过程中易在戊室形成水垢
【答案】C
【解析】
在电解池中,阳离子向阴极移动,阴离子向阳极移动,因此,阳离子向右移动,阴离子向左移动,而阳离子只能通过阳膜,阴离子只能通过阴膜,综上可知,乙室和丁室的溶液中部分阴阳离子浓度增大,丙室中阴阳离子浓度减小;在甲室,Cl-在阳极失去电离生成Cl-,在戊室,水会得到电子,生成氢气。
A.甲室中的电极为阳极,Cl-放电生成Cl2,电极反应为甲室的电极反应式为:2Cl--2e-=Cl2↑,A正确,不选;
B.甲室Cl-放电,阳离子甲室进入乙室,戊室2H2O+2e-=H2↑+2OH-,阴离子戊室进入丁室,丙室的阳离子进入丁室,阴离子进入乙室,因此乙室和丁室中部分离子的浓度增大,丙中得到淡水,其出口为b;B正确,不选;
C.戊室收集到1molH2,转移2mol电子,由甲室进入乙室的阳离子可能为Na+、K+,也可能是Mg2+、Ca2+,其电荷不同,C错误,故选C;
D.戊室生成的![]() 可能与
可能与![]() 结合生成水垢,D正确,不选。
结合生成水垢,D正确,不选。
答案选C。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】有机物A是一种重要的化工原料,以A为主要起始原料,通过下列途径可以合成高分子材料PA及PC。

试回答下列问题
(1)B的化学名称为_____________,B到C的反应条件是_____________;
(2)E到F的反应类型为_____________,高分子材料PA的结构简式为_____________;
(3)由A生成H的化学方程式为_______________________________________;
(4)实验室检验有机物A,可选择试剂_____________或_____________;
(5)E的同分异构中,既能与碳酸氢钠溶液反应又能发生银镜反应的有机物共有_____________种。其中核磁共振氢谱图有5组峰,且峰面积之比为6:1:1:1:1的物质的结构简式为_____________;
(6)由B通过三步反应制备1,3-环己二烯的合成路线为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某三元羧酸H3A在表面活性剂、洗涤剂、润滑剂等方面具有重要的地位。常温时,向10mL0.01mol·L-1的H3A溶液中滴入0.01mol·L-1的NaOH溶液,H3A、H2A-、HA2-、A3-的物质的量分数与溶液的pH的关系如图所示。则下列说法中错误的是( )

A.常温时,0.01mol·L-1的H3A溶液的pH介于2~3之间
B.常温时,反应A3-+H2O ![]() HA2-+OH-的平衡常数为K=10c-14
HA2-+OH-的平衡常数为K=10c-14
C.若b=7,则将等物质的量的NaH2A与Na2HA加入到适量蒸馏水中使其完全溶解,则所得的溶液的pH一定等于7
D.加入NaOH溶液的体积为30mL时,所得溶液中存在有:c(OH-)=3c(H3A)+2c(H2A-)+c(HA2-)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列实验仪器和实验操作的有关问题。


(1)图A中试管夹的作用是______________________。
(2)指出图B中的错误操作是____________________________________。
(3)图C、D是某同学配制50 g质量分数为6%的氯化钠溶液时,在称量和量取两个操作步骤中出现的情况:
①如图C所示:在称量氯化钠的操作过程中,发现指针偏右,则继续进行的操作是______________,至天平平衡。
②如图D所示,量取水时,仰视读数,所得溶液中溶质的质量分数会______________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示是某品牌饮用矿泉水标签的部分内容。

请认真阅读标签内容,计算:
(1)镁离子的物质的量浓度的最大值_______。
(2)一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过多少_______?(单位:mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究用AgNO3溶液将混合溶液中的Cl-和CrO42-沉淀分离,绘制了25℃时AgCl和Ag2CrO4两种难溶化合物的溶解平衡曲线。其中,pAg+=-lgc(Ag+),其余离子类推。两条相交曲线把图像分成了X、Y、Z、M四个区域。下列说法错误的是( )
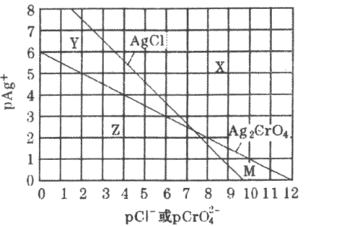
A.Ksp(Ag2CrO4)约为1×10-12,Ksp(AgCl)的数量级为10-10
B.M区域内可析出Ag2CrO4沉淀,而不析出AgCl沉淀
C.向Ag2CrO4,AgCl混合固体和水组成的溶解平衡体系中加入少量水,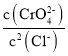 增大
增大
D.向Cl-,CrO42-均为0.1mol·L-1的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中各元素原子的第一电离能大小顺序是F>O>______________。基态K+电子占据最高能级的电子云轮廓图为_____________形。
(2) NaBH4是有机合成中常用的还原剂,其中阴离子的键角为___________。
(3)下列硼原子电子排布图表示的状态中,能量最低和最高的分别为___________、___________(填字母标号)。
A.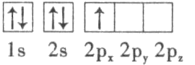 B.
B.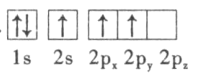
C. D.
D.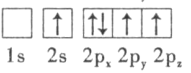
(4)硼元素的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
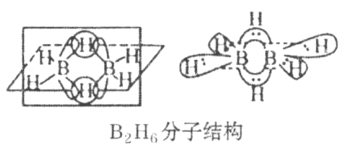
①B2H6分子结构如图,则B原子的杂化方式为_________。
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是_______________,写出一种与氨硼烷互为等电子体的分子________________(填化学式)。
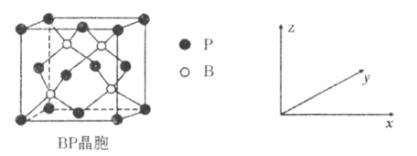
(5)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。P的配位数为_____________,磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是_______________,已知晶胞边长为apm,则磷化硼晶体的密度是___________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁条、铝条平行插入盛有一定浓度的NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示。此电池工作时,下列叙述正确的是( )

A. Mg比Al活泼,Mg失去电子被氧化成Mg2+
B. 铝条表面虽有氧化膜,但可不必处理
C. 该电池的内外电路中,电流均是由电子定向移动形成的
D. Al是电池负极,开始工作时溶液中会立即有白色沉淀析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com