
����Ŀ�����������(KBe2BO3F2)�Ǽ������ĺ��IJ��ϣ��ҹ���ѧ���ڴ�������о��������������ǰ�С��ش���������:
(1)����������и�Ԫ��ԭ�ӵĵ�һ�����ܴ�С˳����F>O>______________����̬K������ռ������ܼ��ĵ���������ͼΪ_____________�Ρ�
(2) NaBH4���л��ϳ��г��õĻ�ԭ�������������ӵļ���Ϊ___________��
(3)������ԭ�ӵ����Ų�ͼ��ʾ��״̬�У�������ͺ���ߵķֱ�Ϊ___________��___________(����ĸ���)��
A.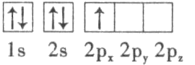 B.
B.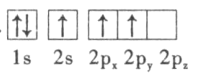
C. D.
D.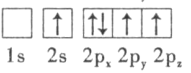
(4)��Ԫ�صļ��⻯��BH3����������ڣ����������γɽ��ȶ���B2H6�����������ӽ�ϡ�
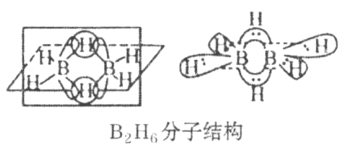
��B2H6���ӽṹ��ͼ����Bԭ�ӵ��ӻ���ʽΪ_________��
��������(NH3BH3)����Ϊ�����DZ�������ʹ������֮һ�������д�����λ�����ṩ�µ��ӶԵijɼ�ԭ����_______________��д��һ���백���黥Ϊ�ȵ�����ķ���________________(�ѧʽ)��
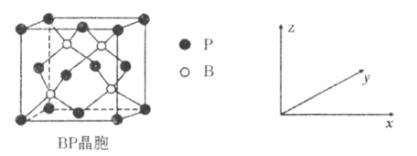
(5)����(BP)���ܸ߶ȹ�ע����ĥ���ϣ�����Ϊ��������ı����㣬��ṹ����ʯ���ƣ������ṹ��ͼ��ʾ��P����λ��Ϊ_____________��������z����ƽ���ͶӰͼ�У�Bԭ�ӹ��ɵļ�����״��_______________����֪�����߳�Ϊapm������������ܶ���___________g��cm��3��
���𰸡�![]() ����(�Ĵ�)
����(�Ĵ�) ![]() A D
A D ![]() N
N ![]() 4 ������
4 ������ 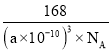
��������
(1)һ������£�ͬ����Ԫ�ش����ң���һ������������ͬ����Ԫ�ش��ϵ��£���һ��������С�����ǵڢ�A��Ԫ�غ͵ڢ�A��Ԫ���������������Ų�����ȫ�����߰��������һ�����ܱ�����Ԫ�ش���K��Be��B�ĵ���������ΪBe>B>K��
KΪ19��Ԫ�أ����������Ų�Ϊ1s22s22p63s23p64s1��ʧȥ�������ӵõ�K����K���ĺ�������Ų�Ϊ1s22s22p63s23p6��ռ�ݵ�����ܼ�Ϊ3p�������������ͼΪ����(�Ĵ�)�Σ�
(2)������ΪBH4������۲���Ӷ���ĿΪ![]() �������й¶Ե��ӣ���Ϊ���������Σ�����Ϊ109��28�䣻
�������й¶Ե��ӣ���Ϊ���������Σ�����Ϊ109��28�䣻
(3)���պ�������Ų���������ԭ�Ӻ����Ų�ʱ��Ҫ������ʹ���ӵ�������ͣ��������ʱ��������������͵��Dz㣬���������ԭ�Ӻ����Ų�ʱ���������ܷ�ռ��ͬ�Ĺ����������ƽ�У����֪������͵�ΪA��������ߵ�ΪD��
(4)�ٸ���ͼʾ��B��4��Hԭ���γɹ��ۼ�����Bԭ�ӵ��ӻ���ʽΪsp3��
��N������5�����ӣ���B������3�����ӣ�N��3��Hԭ���γɹ��ۼ�������һ�Թ¶Ե��ӣ�B��3��Hԭ���γɹ��ۼ���û�ж���ļ۵��ӣ����NH3BH3�У�N�����ṩ�¶Ե��ӣ�B�����ṩ�չ�����γ���λ��������ṩ�µ��ӶԵijɼ�ԭ����N���ȵ�������ָ�۵�������ԭ������ͬ�ķ��ӡ����ӻ�ԭ���ţ���NH3BH3�ĵȵ��������ΪC2H6��
(5)�����µ����Pԭ�ӿ�֪�����µ�������ĵ�Pԭ�Ӿ���2��Oԭ�����������ݾ��������ظ��ԣ���֪ÿ��Pԭ�ӵ���λ��Ϊ4��������4��Bԭ�ӷֲ�����������Ϊ���ĵ���������λ�ã��丩��ͼ��4��Bԭ���γ������Σ����ݾ�̯���������к���4��Bԭ�ӣ�Pԭ����=![]() ����������
����������![]() ���������
���������![]() �������ܶ�
�������ܶ�![]() ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����(����)
A.�����£�pH��3��CH3COOH��Һ��pH��11��NaOH��Һ�������ϣ�������ҺpH>7
B.�����£�Na2CO3��Һ�м�������Ca(OH)2���壬��Һ��![]() ��ֵ����
��ֵ����
C.����ӵ����������������У��뽫�������ĸ����豸��ֱ����Դ�ĸ�������
D.��ӦNH3(g)��HCl(g)=NH4Cl(s)�����������Է����У��÷�Ӧ����H>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ��
��![]() ��
��![]() ��
��![]() Ϊ������Ԫ�أ���ԭ�Ӱ뾶�����ϼ۵���Ϣ���±�������˵��һ����ȷ���ǣ� ��
Ϊ������Ԫ�أ���ԭ�Ӱ뾶�����ϼ۵���Ϣ���±�������˵��һ����ȷ���ǣ� ��
Ԫ�� |
|
|
|
|
ԭ�Ӱ뾶�� | 0.077 | 0.070 | 0.104 | 0.099 |
������ۻ������ | +4 | +5 | -2 | -1 |
A.![]() ��
��![]() �γɵĻ�����ĵ���ʽ�ɱ�ʾΪ
�γɵĻ�����ĵ���ʽ�ɱ�ʾΪ![]()
B.![]() ���⻯������
���⻯������![]() ���⻯�ﷴӦ�����ò���ֻ���й��ۼ�
���⻯�ﷴӦ�����ò���ֻ���й��ۼ�
C.![]() ��
��![]() �ֱܷ�����Ԫ���γɶ���������
�ֱܷ�����Ԫ���γɶ���������
D.![]() ����Ԫ��ͬ���е������ڢ�A��
����Ԫ��ͬ���е������ڢ�A��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ˮ����Ҫ���ӵĺ������±������������������������е���������ԭ����ͼ��ʾ(����Ϊ���Ե缫����Ĥֻ����������ͨ������Ĥֻ����������ͨ��)�������й�˵���������( )
���� |
|
|
|
|
|
|
|
���� | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
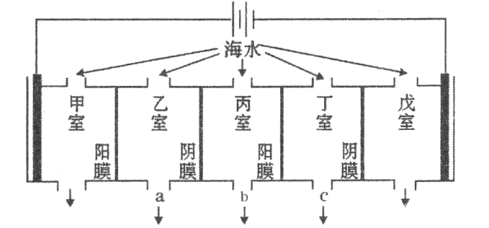
A.���ҵĵ缫��ӦʽΪ��![]()
B.���ҺͶ����в������ӵ�Ũ������ˮ�ij���Ϊb
C.�������ռ���![]() (��״��)����ʱ��ͨ��������Ĥ�����ӵ����ʵ���һ��Ϊ
(��״��)����ʱ��ͨ��������Ĥ�����ӵ����ʵ���һ��Ϊ![]()
D.�������������������γ�ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µĶ����ܱ������У��������������ӦA(s)��2B(g)![]() C(g)+D(g) �Ѵﵽ��Ӧ�ȵ���
C(g)+D(g) �Ѵﵽ��Ӧ�ȵ���
A. ���������ܶȱ��ֲ���B. ��1mol C���ɵ�ͬʱ��1mol D����
C. �������������ʵ������ֲ���D. ��1 mol A���ɵ�ͬʱ��1mol C����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�ڷ�ӦA(g)+3B(g)��2C(g)�У���������A��ʾ�ĸ÷�Ӧ�Ļ�ѧ��Ӧ����Ϊ0.2 mol��L1��min1����������B��ʾ�˷�Ӧ�Ļ�ѧ��Ӧ����Ϊ________mol��L1��min1��
(2)��2 L���ܱ������У�����2 mol N2��3 mol H2����һ�������·�����Ӧ��3 s����N2Ϊ1.9 mol������H2��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ____________________________��
(3)��10 mol A��5 mol B�����ݻ�Ϊ10 L���ܱ������У�ij�¶��·�����Ӧ��3A(g)+B(g) ![]() 2C(g)�������2 s�ڣ�����A��ƽ������Ϊ0.06 mol��L1��s1������2 sʱ����������______ mol A����ʱC�����ʵ���Ũ��Ϊ________��
2C(g)�������2 s�ڣ�����A��ƽ������Ϊ0.06 mol��L1��s1������2 sʱ����������______ mol A����ʱC�����ʵ���Ũ��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�������NO2��O2���Թܵ�����ˮ���У���ַ�Ӧ��ʣ����������Ϊԭ������������![]() ����ԭ���������NO2��O2�����֮����
����ԭ���������NO2��O2�����֮����
A.8��1B.7��3C.1��7D.4��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���ס������ص缫���϶���������̼������ش��������⣺
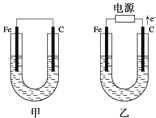
��1���������е������Һ��ΪCuSO4��Һ����Ӧһ��ʱ���
���к�ɫ�����������Ǽ׳��е�___�����ҳ��е�___����
���ҳ��������ĵ缫��Ӧʽ��___��
��2���������е������Һ��Ϊ����NaCl��Һ��
��д���ҳ����ܷ�Ӧ�����ӷ���ʽ___��
�ڼ׳���̼���ϵ缫��Ӧʽ��___���ҳ�̼���ϵ缫��Ӧ����___���������Ӧ����ԭ��Ӧ������
�۽�ʪ���KI������ֽ�����ҳ�̼��������������ֽ��������Ӧ�Ļ�ѧ����ʽΪ___��
�����ҳ�ת��0.02mole����ֹͣʵ�飬���е������Һ�����200mL������Һ��Ͼ��Ⱥ��pH��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)����KCl��Һ��K2CO3���Լ���___________�����ӷ���ʽΪ________________��
(2)��ȥ����NaCl��Һ������NaHCO3���ʵ��Լ���________�����ӷ���ʽΪ___________��
(3)��ȥNa2CO3��ĩ�л����NaHCO3������________��������ѧ����ʽΪ_____________��
(4)��ȥ�����л������۵��Լ���___________�����ӷ���ʽΪ_________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com