
����Ŀ����1��������ʵ�����Ʒ��Ļ�ѧ����ʽΪ________����ͼ��ʾ������������ͨ��ʢ�и�����ɫ�����Ĺ��ƿA��ʢ�г�ʪ��ɫ�����Ĺ��ƿB���ɹ۲쵽��������______��
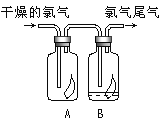
��2����ҵ�ϳ������۵�ʯ�������չ�ҵ����β���Ƶ�Ư�ۣ�����¶���ڿ����е�Ư�ۣ���ϡ����������������_________������ĸ�������
A��O2 B��Cl2 C��CO2 D��HClO
��3��ʵ��������ͼ��ʾװ����ȡ�������ռ�����Ӧʹ��___�������Ⱥ�պ��Ũ����IJ������������ܿ�,������������________��Ҫ�õ�����İ�����ѡ��___���������������������ø�װ����ȡ�ij���������_______��
���𰸡�MnO2+4HCl(Ũ)![]() MnCl2+Cl2+2H2O ������ɫ��������������ʪ��ɫ������ɫ C �����ſ��� �������� ��ʯ�� ����
MnCl2+Cl2+2H2O ������ɫ��������������ʪ��ɫ������ɫ C �����ſ��� �������� ��ʯ�� ����
��������
��1��ʵ�����Ʊ�����������MnO2��Ũ���ᷴӦ������Ӧ����ʽΪMnO2��4HCl(Ũ) ![]() MnCl2��Cl2����2H2O���������������ʹ�������ɫ������ɫ����ʹʪ�����ɫ������ɫ��
MnCl2��Cl2����2H2O���������������ʹ�������ɫ������ɫ����ʹʪ�����ɫ������ɫ��
��ΪMnO2��4HCl(Ũ) ![]() MnCl2��Cl2����2H2O��������ɫ��������������ʪ��ɫ������ɫ��
MnCl2��Cl2����2H2O��������ɫ��������������ʪ��ɫ������ɫ��
��2��Ư�۵ijɷ���CaCl2��Ca(ClO)2����Ч�ɷ���Ca(ClO)2����Ϊ̼�������ǿ��HClO��Ư�۳��ڷ����ڿ���������Ca(ClO)2��CO2��H2O=CaCO3����2HClO��HClO����ֽ��ΪHCl��O2�������������CaCO3��2HCl=CaCl2��CO2����H2O������������ΪCO2��ѡ��C��ȷ��
��ΪC��
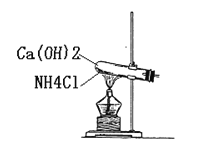
��3����Ϊ������������ˮ����˲����ſ������ռ����������ܶ�С�ڿ��������������ſ������ռ���Ũ������лӷ��ԣ����߷���NH3��HCl=NH4Cl��NH4ClΪ���壬�������Dz������̣�ʵ���Ҹ��ﰱ�������ü�ʯ�ң���װ��Ϊ���士����![]() ���壬�������ø�װ���Ʊ�������
���壬�������ø�װ���Ʊ�������
��Ϊ�����ſ������������̣���ʯ�ң�������


 ������ȫ�̼����ĩ���100��ϵ�д�
������ȫ�̼����ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E���ֻ����� ��������ij�ֳ�������Ԫ�أ����ǵ�ת����ϵ��ͼ��ʾ������AΪ������Һ��CΪ���ܵİ�ɫ���壬E��������ˮ����ȡA��Һ���գ���ɫ��ӦΪ��ɫ������ɫ�ܲ����۲죩��

��ش��������⣺
��1��д����ѧʽ��B____________��D___________��
��2�����ֻ�������������ˮ����___________________���ѧʽ����
��3��д�����з�Ӧ�����ӷ���ʽ��
A��B��_________________________________________________��
B��E��_________________________________________________��
C��E��_________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�������Լ�ƿ��ǩ�ϵ����ݣ�

��1��ij��ѧ��ȤС������������ʵ�ʵ��̽��ʱ����Ҫ490mL0.92mol��L-1��ϡ���ᣬ��Ҫ���Ƹ�Ũ�ȵ���Һ����IJ�����������Ͳ���ձ�������������ͷ�ι��⣬����Ҫ__�����������ƣ�����Ҫ��ȡ98%Ũ����__mL�������ƣ�
��2��������Һʱ�����²�����a.ϡ���ܽ�b.ҡ��c.ϴ��d.��ȴe.��ȡf.����Һ��������ƿg.���ݣ�ʵ�����˳����ȷ������_____��
A.e��a��f��d��c��f��g��b B.e��a��d��f��c��f��g��b
C.e��a��f��d��c��f��b��g D.e��a��d��f��c��f��b��g
��3��������0.92mol��L-1ϡ����Ĺ����У���������������������õ�������Һ���ʵ���Ũ��ƫ�͵���__��
A.δ����ȴ���Ƚ���Һע������ƿ�� B.��ȡŨ����ʱ���Ӷ���
C.����ʱ���ӹ۲�Һ�� D.δϴ���ձ��Ͳ�����
��4��Ϊ�к�100mL2.3mol��L-1KOH��Һʹ��ǡ����ȫ��Ӧ����Ҫ����__mL0.92mol��L-1ϡ���ᡣ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӽױ����������������̿��Ժϳɱ����ᱽ������ˮ���ᡣ
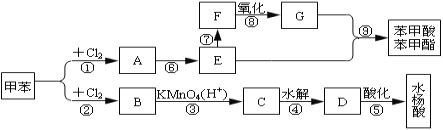
��֪ˮ����Ľṹ��ʽΪ![]() �ҷ��ǻ��ױ���������ش�
�ҷ��ǻ��ױ���������ش�
��1��д�����з�Ӧ����������_____________����_______��
��2��C��F�Ľṹ��ʽ�ֱ�Ϊ��C___��F___��
��3��д����Ӧ�ޡ���Ļ�ѧ����ʽ����________________��_____
��4��д����Ӧ���ͣ���____________ ��____________ ��______________
��5���ۡ���������Ӧ�ܷ���Ϊʲô��___��
��6��д��ˮ�����ͬ���칹�����������Ľṹ��ʽ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ú�������ͭ��[��CuO��Cu2(OH)2CO3��As2O3���ؽ����ε�]��ȡCu2(OH)2SO4�Ĺ����������£�
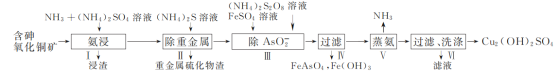
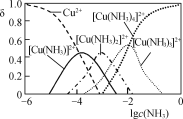
(1) �������������ʱ�������¶�Ϊ50��55 �棬pHԼΪ9.5����ͭ������ת��Ϊ[Cu(NH3)4]SO4��Һ��
�� CuO����ȡ�����ӷ���ʽΪ________��
�ڽ�ȡ�¶Ȳ��˳���55 �棬��ԭ����________��
�� Cu2����NH3���ʱ����Һ�к�ͭ�������ʵ����ֲ�����(��)����Һ�������c(NH3)�Ķ���ֵ�Ĺ�ϵ��ͼ��ʾ������1 L��ȡҺ(�ɵ����ʵ���NH3��NH4+���)��amolCu2(OH)2CO3ȫ������Ϊ[Cu(NH3)4]2��(CO32-ת��ΪHCO3-��������������Ӧ����Һ����仯���Բ���)��ԭ��ȡҺ����ʼʱc(NH3)Ӧ�����������________��
(2) ����AsO2-��ʱ��FeSO4�������һ����ʹAsO2-������ȫ����һĿ����________��
(3) ��������ʱ������Ӧ�Ļ�ѧ����ʽΪ________��
(4) Ϊ��ʵ����������������ѭ�����ã��ɲ�ȡ�Ĵ�ʩΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.�����£���ӦNH3(g)+HCl(g)=NH4Cl(s)���Է�������Ӧ����÷�Ӧ�ġ�H>0
B.�����£������ʵ���Ũ�ȵ�CH3COOH��Һ��HCl��Һ�У�ˮ�ĵ���̶���ͬ
C.�����£�0.1molL��1CH3COONa��Һ��ˮϡ�ͺ���Һ��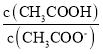 ��ֵ����
��ֵ����
D.�����£���BaCO3��BaSO4�ı�����Һ�м�������BaCl2���壬��Һ��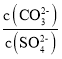 ��С
��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Чȥ����ˮ�е�H2SiF6��F-������ˮ���ǻ������ŵ���Ҫ�о����⡣
��1��AlF3���л��ϳ��г��ô��������÷�ˮ�е�H2SiF6��ת���Ƶã���ص��Ȼ�ѧ����ʽ���£�
3H2SiF6(aq)+2Al(OH)3(s)=Al2(SiF6)3(aq)+6H2O(l)����H=akJ��mol-1
Al2(SiF6)3(aq)+6H2O(l)=2AlF3(aq)+3SiO2(s)+12HF(aq)����H=bkJ��mol-1
3HF(aq)+Al(OH)3(s)=AlF3(aq)+3H2O(l)����H=ckJ��mol-1
��ӦH2SiF6(aq)+2Al(OH)3(s)=2AlF3(aq)+SiO2(s)+4H2O(l)����H=__kJ��mol-1��
��2����ˮ�����ȼ���ˮ�е�Fe3+��F-Ũ�ȵIJⶨ�������һ����Ӱ�졣
�ٲⶨʱ��ͨ�����Ʒ�ˮ��pH��5��6֮�䡣pH��С����F-Ũ��ƫ�ͣ���ԭ����__��
��Fe3+���������(C6F5O73-)��F-��Ӧ�ɱ�ʾΪFe3++nC6H5O73-![]() Fe(C6H5O7)n(3n-3)-��Fe3++nF-
Fe(C6H5O7)n(3n-3)-��Fe3++nF-![]() FeFn(3-n)������Fe3+�ĺ�����ˮ�м�����������(C6H5O7Na3)������Fe3+��F-�ⶨ�ĸ��ţ���ԭ����__��
FeFn(3-n)������Fe3+�ĺ�����ˮ�м�����������(C6H5O7Na3)������Fe3+��F-�ⶨ�ĸ��ţ���ԭ����__��
��3�����þ۱���������ȥ��ˮ��F-���ö��Ե缫��ⱽ��(![]() )������Ļ��Һ����������þ۱�����Ĥ���仯������ͼ��
)������Ļ��Һ����������þ۱�����Ĥ���仯������ͼ��
![]()
д���������ɶ�����ĵ缫��Ӧ����ʽ��___��
��4������MgCO3��Ca(OH)2��CaCO3�ȿɳ���ȥ����ˮ��F-��
����MgCl2��Һ������[CO(NH2)2]Ϊԭ�Ͽ��Ƶ�MgCO3��д���÷�Ӧ�Ļ�ѧ����ʽ��__��
��ȡ������ͬ�ĺ�F-�����Է�ˮ���ֱ����������MgCO3��Ca(OH)2��CaCO3����ͬʱ�����Һ��pH��F-��������ͼ1��ʾ��ʵ�ʷ�ˮ���������г�ѡ��MgCO3�������ǣ�__��
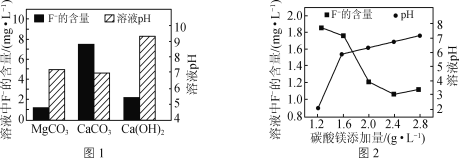
�۸ı�̼��þ���������������ˮ��F-��������ҺpH�ı仯��ͼ2��ʾ������������2.4g��L-1��F-�����������ߵ�ԭ����___��{Ksp(MgF2)=7.4��10-11��Ksp[Mg(OH)2]=5.6��10-12}
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijЩ������Ǧ�ο�����Ϳ�ϣ�����ٸ�ʻ���ʹ�õ�Ǧ��(PbCO3)�ͻƽ����л�ɫ��PbI2�������£�PbCO3 �� PbI2 �ڲ�ͬ����Һ�зֱ�ﵽ�ܽ�ƽ��ʱ-lgc(Pb2+)��-lgc(CO32-)��-lgc(I-)�Ĺ�ϵ��ͼ��ʾ������˵���������
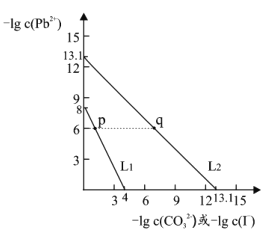
A.Ksp(PbCO3)��������Ϊ 10-14
B.��ͬ�����£�ˮ�ĵ���̶� p ����� q ��
C.L1 ��Ӧ����-lgc(Pb2+)��-lgc(I-)�Ĺ�ϵ�仯
D.p ����Һ�м��� Na2CO3 Ũ��Һ���ɵð�ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ�50mL 0.50mol/L������50mL 0.55mol/LNaOH��Һ��ͼʾ��װ���н����кͷ�Ӧ���ش��������⣺
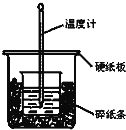
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ���������___________��
��2�����ձ����������Ӳֽ�壬��õ��к�����ֵ__________������ƫ��������ƫС��������Ӱ��������
��3��ʵ���и���60mL 0.50mol/L�����50mL 0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ������к���________�������������������������������ɣ�______________________��
��4��������Һ���ܶȶ���1g/mL���кͺ�������Һ�ı�����c=4.18J/��g���棩������ƽ�в��������ֹ�¶�����ʼ�¶Ȳt2��t1���ֱ�Ϊ����3.2�� ��2.2�� ��3.0�棬д����ʾ������NaOH��Һ��Ӧ���к��ȵ��Ȼ�ѧ����ʽ________________________����С�������һλС����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com