
����Ŀ���ú�������ͭ��[��CuO��Cu2(OH)2CO3��As2O3���ؽ����ε�]��ȡCu2(OH)2SO4�Ĺ����������£�
(1) �������������ʱ�������¶�Ϊ50��55 �棬pHԼΪ9.5����ͭ������ת��Ϊ[Cu(NH3)4]SO4��Һ��
�� CuO����ȡ�����ӷ���ʽΪ________��
�ڽ�ȡ�¶Ȳ��˳���55 �棬��ԭ����________��
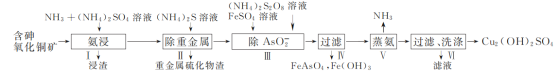
�� Cu2����NH3���ʱ����Һ�к�ͭ�������ʵ����ֲ�����(��)����Һ�������c(NH3)�Ķ���ֵ�Ĺ�ϵ��ͼ��ʾ������1 L��ȡҺ(�ɵ����ʵ���NH3��NH4+���)��amolCu2(OH)2CO3ȫ������Ϊ[Cu(NH3)4]2��(CO32-ת��ΪHCO3-��������������Ӧ����Һ����仯���Բ���)��ԭ��ȡҺ����ʼʱc(NH3)Ӧ�����������________��
(2) ����AsO2-��ʱ��FeSO4�������һ����ʹAsO2-������ȫ����һĿ����________��
(3) ��������ʱ������Ӧ�Ļ�ѧ����ʽΪ________��
(4) Ϊ��ʵ����������������ѭ�����ã��ɲ�ȡ�Ĵ�ʩΪ________��
���𰸡�CuO+2NH3+2NH4+=[Cu(NH3)4]2��+H2O �¶ȹ��ߣ������NH3�Ļӷ� c(NH3)��(5a��1) mol��L��1 ���ɵ�Fe(OH)3[��Fe(OH)3��Fe(OH)2]��״��������FeAsO4�Ⱥ����� 2[Cu(NH3)4]SO4![]() Cu2(OH)2SO4����6NH3��+(NH4)2SO4 �ò����������NH3�벽�������Һ���Ʋ���������NH3��(NH4)2SO4��ȡҺ
Cu2(OH)2SO4����6NH3��+(NH4)2SO4 �ò����������NH3�벽�������Һ���Ʋ���������NH3��(NH4)2SO4��ȡҺ
��������
�������̣���NH3��(NH4)2SO4��ɵ���Һ������������ͭ��[��CuO��Cu2(OH)2CO3��As2O3���ؽ����ε�]����ͭ������ת��Ϊ[Cu(NH3)4]SO4��Һ��ͬʱ�����ؽ����κ�AsO2-��������麟�ȥ�ؽ������ӣ��ټ���(NH4)2S2O8��FeSO4������AsO2-������FeAsO4��Fe(OH)3�������õ�����Һ��ҪΪ(NH4)2SO4��[Cu(NH3)4]SO4��Һ�����������ˡ�ϴ�ӵõ���ƷCu2(OH)2SO4��
(1)��CuO��NH3��(NH4)2SO4��ɵ���Һ��ȡ�õ�[Cu(NH3)4]SO4���ݴ���д��
���¶ȸߣ�����ٰ����Ļӷ���
����ͼ��֪��ȫ������Ϊ[Cu(NH3)4]2+ʱlgc(NH3)=0�����ʱ����Ũ��c(NH3)=1mol/L���ٽ�Ϸ�Ӧ��Cu2(OH)2CO3+5NH3+3NH4+�T2[Cu(NH3)4]2++HCO3-+2H2O��������ɵã�
(2)���������еõ�FeAsO4��Fe(OH)3����������
(3)��������ʱ������ӦΪ[Cu(NH3)4]SO4�ֽ�Cu2(OH)2SO4�Ͱ��������ԭ���غ�ɵã�
(4)�������̷����ɵõ�NH3-(NH4)2SO4��ȡҺѭ��ʹ�á�
(1)CuO��NH3��(NH4)2SO4��ɵ���Һ��ȡ�õ�[Cu(NH3)4]SO4����Ӧ�����ӷ�ӦΪ��CuO+2NH3+2NH4+=[Cu(NH3)4]2++H2O��
�ڽ�ȡ�¶Ȳ��˳���55�棬���Ƿ�Ӧ�¶ȹ��ߣ������NH3�Ļӷ���
��a molCu2(OH)2CO3ȫ������Ϊ[Cu(NH3)4]2+�ķ�ӦΪ��Cu2(OH)2CO3+5NH3+3NH4+=2[Cu(NH3)4]2++HCO3-+2H2O����������뷴Ӧ�İ���Ϊ5amol��Ũ��Ϊ5amol/L����ͼ��֪��ȫ������Ϊ[Cu(NH3)4]2+ʱ��lgc(NH3)=0�����ʱ����Ũ��c(NH3)=1mol/L�����ԭ��ȡҺ����ʼʱc(NH3)��(5a+1)mol/L��
(2)�����У�����AsO2-��ʱ�õ�FeAsO4��Fe(OH)3������FeSO4�������һ����ʹAsO2-������ȫ����һĿ�������ɵ�Fe(OH)3[��Fe(OH)3-Fe(OH)2]��״��������FeAsO4�Ⱥ�������
(3)�������̣���������ʱ������ӦΪ[Cu(NH3)4]SO4�ֽ�Cu2(OH)2SO4�Ͱ�������Ӧ����ʽΪ��
2[Cu(NH3)4]SO4![]() Cu2(OH)2SO4����6NH3����(NH4)2SO4��
Cu2(OH)2SO4����6NH3����(NH4)2SO4��
(4)�ò����������NH3�벽�������Һ���Ʋ���������NH3-(NH4)2SO4��ȡҺ��������������������ѭ�����á�


 ��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д� Сѧ��ĩ���Ծ�ϵ�д�
Сѧ��ĩ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������-��-���š���ѧϰ��ѧ����Ҫ���ݺͷ����������й�˵��������ǣ� ��

A.�����������������ʵ��������Ϊ����
B.�����������Եó�����Ϊ�����ǻ�ѧ��Ӧ����Ӧǰ������������ᷢ���仯
C.�˷�Ӧ��̼Ԫ�صĻ��ϼ�����
D.ͼ����ʾ������̼����Ԫ�ص���������3:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۲������ķ�ͼ����ͼ������ȷ��˵����

�ټ��й���5�ֺ�����
���������ÿ�ֵ����ʵĻ������Ҷ�ԼΪ20��
����ɱ�������ĵ�������������
��������ϸ���ڼ��Ļ����ﶡ�ܿ���������
A. 1�� B. 2�� C. 3�� D. 4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
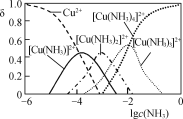
����Ŀ����֪CsCl������ܶ�Ϊ��g��cm��3��NAΪ�����ӵ����������ڵ�����Cs���ĺ˼��Ϊacm����ͼ��ʾ����CsCl����Է����������Ա�ʾΪ(����)
A. NA��a3���� B. ![]() C.
C. ![]() D.
D. ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������仯�����ںϽ�����Լ������ȷ���Ӧ�ù㷺���Իش��������⣺
��1��Ni2+�����Ų��У���������������ߵ��ܼ�����Ϊ______��
��2������Ni����CO�γ������Ni��CO��4����CO��Ϊ�ȵ������һ�ַ���Ϊ______��д��ѧʽ����ͬ������CO��Ϊ�ȵ������һ������Ϊ______��
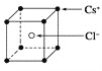
��3������ͪ뿣�![]() ���Ǽ���Ni2+�������Լ�������ͪ뿷�����Cԭ�ӹ���ӻ�����Ϊ______��2mol����ͪ뿷����������Ҽ�����ĿΪ______��
���Ǽ���Ni2+�������Լ�������ͪ뿷�����Cԭ�ӹ���ӻ�����Ϊ______��2mol����ͪ뿷����������Ҽ�����ĿΪ______��
��4������ͪ뿳���NI2+�γ�ͼA��ʾ������ͼB��������Ľ����
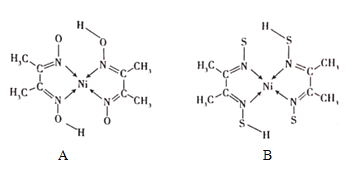
��A���ۡ��е����B��ԭ��Ϊ______��
��B���庬�л�ѧ��������Ϊ______����ѡ����ĸ����
A���Ҽ�B��������C����λ��D���м�
��5���˹��ϳɵ���������������ȱ�ݣ�ijȱ�������������ΪNi0.97O������NiԪ��ֻ��+2��+3���ּ�̬�����ּ�̬����������Ŀ֮��Ϊ______��
��6��Ni2+��Mg2+��O2-�γɾ���ľ����ṹ��ͼ��ʾ��Ni2+δ����������þ���Ļ�ѧʽΪ______��
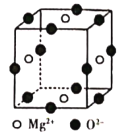
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ��������£�����ѡ����ʾ�����ʼ�ת������ʵ�ֵ���(����)
A. Cu2S(s)![]() Cu(s)
Cu(s)![]() CuCl2(s)
CuCl2(s)
B. SiO2(s)![]() H2SiO3(s)
H2SiO3(s)![]() Na2SiO3(aq)
Na2SiO3(aq)
C. Fe(s)![]() Fe2O3(s)
Fe2O3(s)![]() Fe2(SO4)3(aq)
Fe2(SO4)3(aq)
D. NaCl(aq)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X(5ûʳ������������)���п������ԺͿ���ʲ������Զ����ܹ�ע��X�Ľṹ��ʽ��ͼ��ʾ�������й�X��˵����ȷ���ǡ�(����)

A. ����ʽΪC14H15O10
B. ���������ĸ�����̼ԭ��
C. 1 mol X������4 mol NaOH��Ӧ
D. 1 mol X������4 mol NaHCO3��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪�����Ȼ�ѧ����ʽ��
H2(g)+1/2O2(g)==H2O(l) ��H=285.8 kJ��mol1
H2(g)+1/2O2(g)==H2O(g) ��H=241.8 kJ��mol1
C(s)+ 1/2O2(g)==CO(g) ��H=110.5 kJ��mol1
C(s)+O2(g)==CO2(g) ��H=393.5 kJ��mol1
�ش��������⣺
��ȼ��10gH2����Һ̬ˮ���ų�������Ϊ________��
��CO��ȼ����Ϊ________��
��2��0.3mol����������(B2H6)��������ȼ�գ����ɹ�̬�����������Һ̬ˮ���ų�649.5kJ�������������Ȼ�ѧ����ʽΪ________________________��
��3����֪ϡ��Һ�У�1molH2SO4��NaOH��Һǡ����ȫ��Ӧʱ���ų�114.6 kJ������д��ϡH2SO4��Һ��ϡNaOH��Һ��Ӧ���Ȼ�ѧ����ʽ__________________��
��4����֪��2SO2(g)+O2(g)![]() 2SO3(g) ��H����196.6 kJ��mol�C1
2SO3(g) ��H����196.6 kJ��mol�C1
2NO(g)+O2(g)![]() 2NO2(g) ��H����113.0 kJ��mol�C1
2NO2(g) ��H����113.0 kJ��mol�C1
��д��NO2��SO2��Ӧ����SO3��NO���Ȼ�ѧ����ʽ____________________��
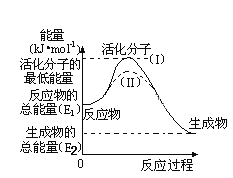
��5���о���ܶ�����Դ�����ĸ����зdz��ش��ʵ�����塣������۲���ͼ���ش����⣺
��ͼ�з�Ӧ�Ħ�H��_____________kJ/mol���ú���E1��E2����ʽ��ʾ����
����֪�Ȼ�ѧ����ʽ��H2(g)��1/2O2(g) �� H2O(g) ��H����241.8kJ/mol���÷�Ӧ�Ļ��Ϊ167.2kJ/mol����H2O(g)��H2(g)��1/2O2(g)�Ļ��Ϊ________kJ/mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.������һ����Ҫ�Ĺ�ҵԭ�ϡ���ҵ�����÷�Ӧ3Cl2��2NH3��N2��6HCl��������ܵ��Ƿ�©����
��1���÷�Ӧ����������____________ ������������____________���õ����ű�ʾ��Ӧ�ĵ���ת��__________________��
��2���ӷ�Ӧ���Կ��������ԣ�Cl2___________N2������>�� ��<����=�� ������71g�������뷴Ӧ������������N2���������״����Ϊ_________________L������С�����һλ����������Աͨ���ܷ������жϹܵ��Ƿ�©��������������Ӧ��д�����ɵİ��̵Ļ�ѧʽ______________��
��.ʵ������������100 mL 0.1mol/L������������Һ���뽫���貹������
����ɵ���Ҫ�������Ƶ�����Ϊ_____________ g��
�������õĹ������С�ձ��У�����������ˮ�ܽ⣻
��������Һ��ȴ�����º��ز�����С��ת��100 mL_________�����������ƣ�
����������ˮ�ձ�2��3�Σ�ÿ��ϴ��Һ��ת������ƿ�У�
����������ˮ��Һ���̶���1��2cm��������____________С�ĵμ�����ˮ���̶��ߴ���ҡ�ȣ�װƿ������ǩ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com