
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. Cu2S(s)![]() Cu(s)
Cu(s)![]() CuCl2(s)
CuCl2(s)
B. SiO2(s)![]() H2SiO3(s)
H2SiO3(s)![]() Na2SiO3(aq)
Na2SiO3(aq)
C. Fe(s)![]() Fe2O3(s)
Fe2O3(s)![]() Fe2(SO4)3(aq)
Fe2(SO4)3(aq)
D. NaCl(aq)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
【答案】A
【解析】
A.硫化亚铜与氧气反应生成氧化铜和二氧化硫,反应的化学方程式为:Cu2S+2O2![]() 2CuO+SO2,铜与氯气反应生成氯化铜,反应为:Cu+Cl2
2CuO+SO2,铜与氯气反应生成氯化铜,反应为:Cu+Cl2![]() CuCl2,A正确;
CuCl2,A正确;
B.SiO2不溶于水,也不能和水反应,所以二者不能直接生成H2SiO3,B错误;
C.铁和水蒸气在高温时反应生成四氧化三铁和氢气,化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2,C错误;
Fe3O4+4H2,C错误;
D.在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子、铵根离子、氯离子和碳酸氢根离子,其中NaHCO3溶解度最小,所以析出NaHCO3,加热NaHCO3分解生成碳酸钠,不是一步生成碳酸钠,D错误;
故合理选项是A。


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】化学计量在化学中占有重要地位,根据相关计算填空:
①3gHe是________ molHe,含有的质子数为_______个。
②1.204×1023个NH3含________mol氨分子,在标准状况下的体积为________L。
③29.4克硫酸中含有原子总数为________ mol,与_______克NH3含有相同数目的氢原子。
④在标准状况下,1.6g某气态氧化物RO2体积为0.56L,该气体的物质的量是________ ,摩尔质量是________ ,R的相对原子量为________ 。
⑤已知Wg气体A含有a个分子,那么在标准状况下,bg气体A所占的体积是________ (其中阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是
![]()
![]() A. ④①②⑤⑥③ B. ④①②⑥⑤③
A. ④①②⑤⑥③ B. ④①②⑥⑤③
![]()
![]() C. ①④②⑥③⑤ D. ①④②③⑥⑤
C. ①④②⑥③⑤ D. ①④②③⑥⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,D,E、F六种元素的原子序数依次增大,其中A元素的原子半径在短周期元素中最小;B原子核外电子有6种不同的运动状态;D原子L层上有2对成对电子。E元素在地壳中含量居第二位,F 与E位于同一周期,且是该周期元素中电负性最大的元素。
根据以上信息回答下列问题:
(1)E元素可分别与D元素、F元素形成两种常见化合物,这两种化合物的熔沸点高低顺序为____________(用化学式表示),原因是_____________________。
(2)C的氢化物比下周期同族元素的氢化物沸点还要高,其原因是____________。
(3)1 mol B2A2分子中含σ键的数目是____________。
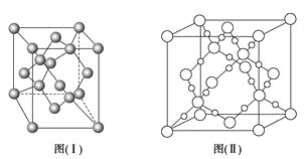
(4)图(Ⅰ)是B元素的单质晶体的一个晶胞,该晶胞中含有_____个原子,该晶体类型为________。
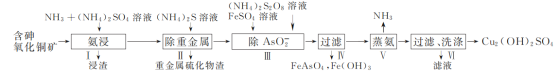
(5)E单质存在与金刚石结构类似的晶体,晶体中原子之间以_________相结合,其晶胞中共有8个原子,其中在面心位置贡献______个原子。
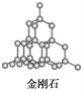
(6)BD2在高温高压下所形成的晶体其晶胞如图(Ⅱ)所示。该晶体的类型属于_______(填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含砷氧化铜矿[含CuO、Cu2(OH)2CO3、As2O3及重金属盐等]制取Cu2(OH)2SO4的工艺流程如下:
(1) 步骤Ⅰ“氨浸”时,控制温度为50~55 ℃,pH约为9.5,含铜化合物转化为[Cu(NH3)4]SO4溶液。
① CuO被浸取的离子方程式为________。
②浸取温度不宜超过55 ℃,其原因是________。
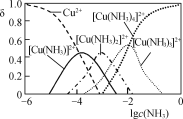
③ Cu2+与NH3结合时,溶液中含铜微粒的物质的量分布分数(δ)与溶液中游离的c(NH3)的对数值的关系如图所示。若用1 L浸取液(由等物质的量NH3和NH4+组成)将amolCu2(OH)2CO3全部浸出为[Cu(NH3)4]2+(CO32-转变为HCO3-,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是________。
(2) “除AsO2-”时,FeSO4需过量,一方面使AsO2-沉淀完全,另一目的是________。
(3) “蒸氨”时发生反应的化学方程式为________。
(4) 为了实现生产过程中物质循环利用,可采取的措施为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
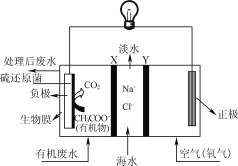
A. 该装置可以在高温下工作
B. X、Y依次为阳离子、阴离子选择性交换膜
C. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D. 该装置工作时,电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的情况。

试回答下列问题:
(1)该反应的化学方程式为________。
(2)0~t1s内气体B的平均反应速率为________。
(3)(t1+10)s时,B的物质的量分数为______,此时v正(A)_____v逆(B)(填“>”“<”或“=”),D点是否处于平衡状态_________(填“是”或“否”)。
(4)下列关于该反应的说法正确的是________ (填序号)。
a.到达t1时刻该反应已停止
b.在t1时刻之前,气体B的消耗速率大于它的生成速率
c.在t1时刻,气体C的正反应速率等于逆反应速率
(5)容器中(t1+10)s时的压强与起始时的压强之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四溴乙烷(CHBr2-CHBr2)是一种无色透明液体,密度2.967 g/mL,难溶于水,沸点244 ℃,可用作制造塑料的有效催化剂等。用电石(主要成分CaC2,少量CaS、Ca3P2、Ca3As2等)和Br2等为原料制备少量四溴乙烷的装置(夹持装置已省略)如图所示。
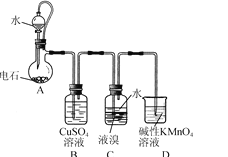
(1)装置A中CaC2能与水剧烈发生反应:CaC2+2H2O→Ca(OH)2+HC≡CH↑。为了得到平缓的C2H2气流,除可用饱和食盐水代替水外,还可采取的措施是________。
(2)装置B可除去H2S、PH3及AsH3,其中除去PH3的化学方程式为________(生成铜、硫酸和磷酸)。
(3)装置C中在液溴液面上加入一层水的目的是________;装置C中反应已完成的现象是________;从装置C反应后的体系得到并纯化产品,需要进行的操作有________。
(4)一种制备Ca10(PO4)6(OH)2的原理为10Ca(OH)2+6H3PO4=Ca10(PO4)6(OH)2↓+18H2O。请设计用装置A得到的石灰乳等为原料制备Ca10(PO4)6(OH)2的实验方案:向烧杯中加入0.25 L含0.5 mol/LCa(OH)2的石灰乳,________,在100 ℃烘箱中烘干1 h。
已知:
① Ca10(PO4)6(OH)2中![]() 比理论值为1.67。影响产品
比理论值为1.67。影响产品![]() 比的主要因素有反应物投料比及反应液pH。
比的主要因素有反应物投料比及反应液pH。
②在95 ℃,pH对![]() 比的影响如图所示。
比的影响如图所示。
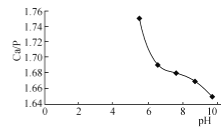
③实验中须使用的试剂:含0.5mol/LCa(OH)2的石灰乳、0.3mol/L磷酸及蒸馏水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释相关的离子方程式错误的是
A. H2S溶于水:H2S+H2O![]() HS-+H3O+
HS-+H3O+
B. 向Na2S2O3溶液中加入稀硫酸:S2O3-+2H+=S↓+SO2↑+H2O
C. NH4Cl溶液呈酸性:NH4++H2O=NH3·H2O+H+
D. K2Cr2O7溶于水:Cr2O7-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com