
【题目】如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的情况。

试回答下列问题:
(1)该反应的化学方程式为________。
(2)0~t1s内气体B的平均反应速率为________。
(3)(t1+10)s时,B的物质的量分数为______,此时v正(A)_____v逆(B)(填“>”“<”或“=”),D点是否处于平衡状态_________(填“是”或“否”)。
(4)下列关于该反应的说法正确的是________ (填序号)。
a.到达t1时刻该反应已停止
b.在t1时刻之前,气体B的消耗速率大于它的生成速率
c.在t1时刻,气体C的正反应速率等于逆反应速率
(5)容器中(t1+10)s时的压强与起始时的压强之比为____。
【答案】3A+B![]() 2C
2C ![]() 33.33% > 是 bc 9:13
33.33% > 是 bc 9:13
【解析】
由图像可知A、B为反应物,C为生成物,到t1秒时达到化学平衡状态,A物质浓度减小了0.6mol/L,B物质浓度减小了0.2mol/L,C浓度增大了0.4mol/L,三者之比为3:1:2,反应最终反应物和生成物共存,说明该反应是可逆反应,由此可知该反应的化学方程式为3A+B![]() 2C。
2C。
(1)由分析可知该反应的化学方程式为3A+B![]() 2C,故答案为:3A+B
2C,故答案为:3A+B![]() 2C;
2C;
(2)根据速率计算公式,0~t1s内气体B的平均反应速率为v(B)=![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
(3)在t1时刻该反应已经达到化学平衡状态,此时B的物质的量分数为![]() ,(t1+10)s时,反应已达化学平衡状态,B的物质的量分数不变,仍为33.33%;平衡时A的正反应速率等于逆反应速率,根据化学反应速率之比等于化学计量系数之比,但化学计量系数A>B,则A的正反应速率大于B的逆反应速率;D点处于t1s和(t1+10)s之间,反应已经处于平衡状态,故答案为:33.33%;>;是;
,(t1+10)s时,反应已达化学平衡状态,B的物质的量分数不变,仍为33.33%;平衡时A的正反应速率等于逆反应速率,根据化学反应速率之比等于化学计量系数之比,但化学计量系数A>B,则A的正反应速率大于B的逆反应速率;D点处于t1s和(t1+10)s之间,反应已经处于平衡状态,故答案为:33.33%;>;是;
(4)a.根据图像可知,到达t1时刻该反应已经处于平衡状态,化学平衡状态是动态平衡,该反应没有停止,故a错误;
b.在t1时刻之前,反应正向进行,气体B的消耗速率大于它的生成速率,故b正确;
c.在t1时刻,反应已经达到化学平衡状态,则气体C的正反应速率等于逆反应速率,故c正确;
综上所述,故答案为:bc;
(5)设该容器的容积为VL,起始的总物质的量为(0.8+0.5)Vmol=1.3Vmol,平衡时总物质的量为(0.2+0.3+0.4)Vmol=0.9Vmol,相同条件下,压强之比等于物质的量之比,所以(t1+10)s时的压强与起始时的压强之比为0.9Vmol:1.3Vmol=9:13,故答案为:9:13。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法中正确的是
A.2.4g金属镁变成镁离子时失去的电子数为0.1NA
B.标况下,mg气体A与ng气体B的分子数相同,则A、B两气体的密度之比为n∶m
C.含有NA个氦原子的氦气的体积约为11.2L
D.1.7gOH-中所含的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CsCl晶体的密度为ρg·cm-3,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为acm,如图所示,则CsCl的相对分子质量可以表示为( )
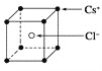
A. NA·a3·ρ B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. Cu2S(s)![]() Cu(s)
Cu(s)![]() CuCl2(s)
CuCl2(s)
B. SiO2(s)![]() H2SiO3(s)
H2SiO3(s)![]() Na2SiO3(aq)
Na2SiO3(aq)
C. Fe(s)![]() Fe2O3(s)
Fe2O3(s)![]() Fe2(SO4)3(aq)
Fe2(SO4)3(aq)
D. NaCl(aq)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X(5没食子酰基奎宁酸)具有抗氧化性和抗利什曼虫活性而备受关注,X的结构简式如图所示。下列有关X的说法正确的是 ( )

A. 分子式为C14H15O10
B. 分子中有四个手性碳原子
C. 1 mol X最多可与4 mol NaOH反应
D. 1 mol X最多可与4 mol NaHCO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧法是测定有机化合物分子式的一种重要方法。0.05mol某烃完全燃烧后,测得生成的二氧化碳为5.6L(STP)、生成的水为5.4g。请通过计推导该烃的分子式,并写出它可能的结构简式及对应的名称。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列热化学方程式:
H2(g)+1/2O2(g)==H2O(l) ΔH=285.8 kJ·mol1
H2(g)+1/2O2(g)==H2O(g) ΔH=241.8 kJ·mol1
C(s)+ 1/2O2(g)==CO(g) ΔH=110.5 kJ·mol1
C(s)+O2(g)==CO2(g) ΔH=393.5 kJ·mol1
回答下列问题:
①燃烧10gH2生成液态水,放出的热量为________。
②CO的燃烧热为________。
(2)0.3mol乙硼烷气体(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量,则其热化学方程式为________________________。
(3)已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出稀H2SO4溶液与稀NaOH溶液反应的热化学方程式__________________。
(4)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol–1
2SO3(g) ΔH=-196.6 kJ·mol–1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol–1
2NO2(g) ΔH=-113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3和NO的热化学方程式____________________。
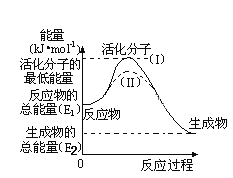
(5)研究活化能对于能源技术的革新有非常重大的实际意义。请认真观察下图,回答问题:
①图中反应的ΔH=_____________kJ/mol(用含有E1、E2代数式表示)。
②已知热化学方程式:H2(g)+1/2O2(g) = H2O(g) ΔH=-241.8kJ/mol,该反应的活化能为167.2kJ/mol,则H2O(g)=H2(g)+1/2O2(g)的活化能为________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,ΔH1=393.5 kJ·mol1,ΔH2=395.4 kJ·mol1,下列有关说法或表示式正确的是( )

A. C(s,石墨) = C(s,金刚石) ΔH=1.9 kJ·mol1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性比石墨的弱
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.乙烯与溴水的反应:CH2=CH2+Br2→CH2CH2Br2
B.铜与稀硝酸反应:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
C.碳铵与盐酸反应:HCO3-+H+=CO2↑+H2O
D.聚丙烯的合成:nCH2=CHCH3![]()
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com