
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。试回答下列问题:
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为______。
(2)金属Ni能与CO形成配合物Ni(CO)4.与CO互为等电子体的一种分子为______(写化学式,下同),与CO互为等电子体的一种离子为______。
(3)丁二酮肟(![]() )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
(4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:
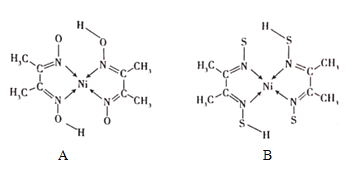
①A的熔、沸点高于B的原因为______。
②B晶体含有化学键的类型为______(填选项字母)。
A.σ键B.金属键C.配位键D.π键
(5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为______。
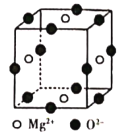
(6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为______。
【答案】3d N2 CN- sp3和sp2 30NA A分子间存在氢键 ACD 91:6 Mg2NiO3
【解析】
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为3d;
(2)原子数与价电子数分别都相等的互为等电子体;
(3)(1)根据价层电子对互斥理论确定中心原子杂化方式,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数;C-H为碳氢σ键,C-C为碳碳σ键,C=N含有一个碳氮σ键;
(4)①A分子中含有-OH,分子间易形成氢键;
②根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间有氢键;根据碳原子成键类型判断。
(5)设+2、+3两种Ni原子数分别为x,y,则x+y=0.97,2x+3y=2,据此计算x:y;
(6)根据晶胞中原子分摊计算Mg2+、O2-的数目分别为2、3,再根据化合物中化合价代数和为0计算Ni2+的数目。
(1)Ni的原子序数是28,因此基态Ni原子中,电子填充的能量最高的能级符号为3d,故答案为:3d;
(2)原子数与价电子数分别都相等的互为等电子体,则与CO互为等电子体的分子为N2,与CO互为等电子体的阴离子为CN-等;故答案为:N2;CN-;
(3)丁二酮肟分子中C原子,甲基上碳原子价层电子对个数是4且不含孤电子对,为sp3杂化,连接甲基的碳原子含有3个价层电子对且不含孤电子对,为sp2杂化,分子中含有13个单键,和2个双键,则共含有15个σ键,所以1mol丁二酮肟含有σ键数目为15NA,2mol丁二酮肟含有σ键数目为30NA,故答案为:sp3和sp2;30NA;
(4)①A分子中含有-OH,分子间易形成氢键,B分子不能形成氢键,故答案为:A分子间存在氢键;
②根据图可知碳碳间形成非极性共价键、碳氮间为极性共价键,氮镍间为配位键,氧氢间形成氢键,无离子键、金属键,故选ACD,故答案为:ACD;
(5)设+2、+3两种Ni原子数分别为x,y,则x+y=0.97,2x+3y=2,解得:x:y=91:6,故答案为:91:6;
(6)晶胞中原子分摊得到Mg2+的数目=4×![]() =2,O2-的数目=12×
=2,O2-的数目=12×![]() =3,化合物中化合价代数和为0,所以Ni2+的数目为1,所以化学式为Mg2NiO3,故答案为:Mg2NiO3。
=3,化合物中化合价代数和为0,所以Ni2+的数目为1,所以化学式为Mg2NiO3,故答案为:Mg2NiO3。


科目:高中化学 来源: 题型:
【题目】薄荷油中含有少量的α—非兰烃和β—非兰烃,两者互为同分异构体,其相对分子质量为136。根据如下化学转化,回答相关问题:

已知: +R’CO2H
+R’CO2H
 +CO2
+CO2
(1)分别写出C→D和D→E的反应类型:___;___。
(2)写出B、F、H、β—非兰烃的结构简式:B:___;F:___;H:___;β—非兰烃:___。
(3)A的同分异构体中含有两个—COOCH3基团的化合物共有___种(不考虑手性异构),其中核磁共振氢谱呈现2个吸收峰的异构体结构简式为___。
(4)α—非兰烃与等物质的量的Br2进行加成反应的产物共有___种(不考虑立体异构)。
(5)写出C→M反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:

下列叙述错误的是
A. X、Y和Z均能使溴水褪色
B. X和Z均能与NaHCO3溶液反应放出CO2
C. Y既能发生取代反应,也能发生加成反应
D. Y可作加聚反应单体,X可作缩聚反应单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量相同的NaHCO3和KHCO3固体混合物9.20g与0.2mol/L盐酸反应。
(1)欲求标准状况下生成CO2的体积,还需要什么数据___。(讨论(2)的问题中,该数据用a表示)
a | 生成CO2的体积(L) |
(2)讨论a值的变化时,产生CO2的体积(标准状况)___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,电化学原理与微生物工艺相组合的电解脱硝法,可除去引起水华的NO3-原理是将NO3-还原为N2。下列说法正确的是( )
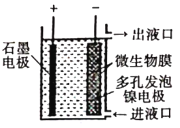
A. 若加人的是![]() 溶液,则导出的溶液呈碱性
溶液,则导出的溶液呈碱性
B. 镍电极上的电极反应式为:![]()
C. 电子由石墨电极流出,经溶液流向镍电极
D. 若阳极生成![]() 气体,理论上可除去
气体,理论上可除去![]() mol
mol![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含砷氧化铜矿[含CuO、Cu2(OH)2CO3、As2O3及重金属盐等]制取Cu2(OH)2SO4的工艺流程如下:
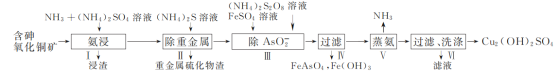
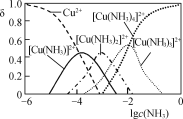
(1) 步骤Ⅰ“氨浸”时,控制温度为50~55 ℃,pH约为9.5,含铜化合物转化为[Cu(NH3)4]SO4溶液。
① CuO被浸取的离子方程式为________。
②浸取温度不宜超过55 ℃,其原因是________。
③ Cu2+与NH3结合时,溶液中含铜微粒的物质的量分布分数(δ)与溶液中游离的c(NH3)的对数值的关系如图所示。若用1 L浸取液(由等物质的量NH3和NH4+组成)将amolCu2(OH)2CO3全部浸出为[Cu(NH3)4]2+(CO32-转变为HCO3-,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是________。
(2) “除AsO2-”时,FeSO4需过量,一方面使AsO2-沉淀完全,另一目的是________。
(3) “蒸氨”时发生反应的化学方程式为________。
(4) 为了实现生产过程中物质循环利用,可采取的措施为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1molNH4+含有的电子数为11NA
B.0.1L3mol/L的NH4NO3溶液中氮原子数等于0.6NA
C.常温下,92gNO2与N2O4混合气体中氧原子数为2NA
D.硫酸铵中既含有离子键,又含有共价键,而氯化铵中只含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S存在于多种燃气中,脱除燃气中H2S的方法很多。
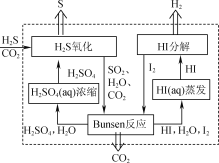
(1) 2019年3月《science direct》介绍的化学链技术脱除H2S的原理如图所示。
①“H2S氧化”反应中氧化剂与还原剂的物质的量之比为________。
②“HI分解”时,每1 mol HI分解生成碘蒸气和氢气时,吸收13 kJ的热量,写出该反应的热化学方程式:________。
③“Bunsen反应”的离子方程式为________。
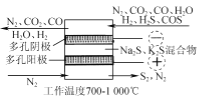
(2) 电化学干法氧化法脱除H2S的原理如图所示。阳极发生的电极反应为________;阴极上COS发生的电极反应为________。
(3) 用Fe2(SO4)3吸收液脱除H2S法包含的反应如下:
(Ⅰ) H2S(g)![]() H2S(aq)
H2S(aq)
(Ⅱ) H2S(aq) ![]() H++HS-
H++HS-
(Ⅲ) HS-+2Fe3+=S↓+2Fe2++H+
一定条件下测得脱硫率与Fe3+浓度的关系如图所示。

①吸收液经过滤出S后,滤液需进行再生,较经济的再生方法是________。
②图中当Fe3+的浓度大于10 g·L-1时,浓度越大,脱硫率越低,这是由于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:
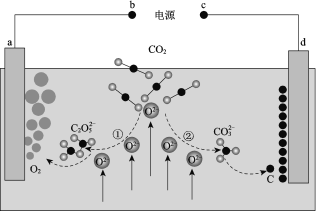
下列说法不正确的是
A. b为电源的正极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极的电极反应式为2C2O52 4e == 4CO2 + O2
D. 上述装置存在反应:CO2 ===== C + O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com