
【题目】物质的量相同的NaHCO3和KHCO3固体混合物9.20g与0.2mol/L盐酸反应。
(1)欲求标准状况下生成CO2的体积,还需要什么数据___。(讨论(2)的问题中,该数据用a表示)
a | 生成CO2的体积(L) |
(2)讨论a值的变化时,产生CO2的体积(标准状况)___
【答案】盐酸的体积aL 盐酸不足量时:a<0.5L,4.48a L;盐酸足量时:a≥0.5L,2.24 L
【解析】
(1)碳酸氢盐与盐酸按1:1反应,盐酸不足量,碳酸氢盐有剩余,应根据HCl的物质的量计算二氧化碳的体积;
(2)设NaHCO3、KHCO3的物质的量均为ymol,则:(84 g·mol-1+100 g·mol-1)×ymol=9.20 g,解得y=0.05mol,当恰好完全反应时,由反应HCO3-+H+=CO2↑+H2O可知,消耗n(HCl)=0.100 mol,M(HCl)=1.00mol·L-1,①当盐酸不足量,即a<0.5L时,按HCl量计算V(CO2);
②当盐酸足量,即a≥0.5L时,按HCO3-的量计算V(CO2);
(1)碳酸氢盐与盐酸按1:1反应,盐酸不足量,碳酸氢盐有剩余,应根据HCl的物质的量计算二氧化碳的体积,所以要计算生成CO2的体积,0.2mol·L-1盐酸,还需要知道盐酸的体积aL,故答案为:盐酸的体积aL;
(2)设NaHCO3、KHCO3的物质的量均为ymol,则:
(84 g·mol-1+100 g·mol-1)×ymol=9.20 g,解得y=0.05mol,当恰好完全反应时,由反应HCO3-+H+═CO2↑+H2O可知,消耗n(HCl)=0.100 mol,V(HCl)=![]() =0.5L。
=0.5L。
①当盐酸不足量,即a<0.5L时,按HCl量计算,V(CO2)=22.4 L·mol-1×n(HCl)=22.4 L·mol-1×0.2mol·L-1×aL=4.48a L;
②当盐酸足量,即a≥0.5L时,按HCO3-的量计算,V(CO2)=22.4 L·mol-1×0.0500mol×2=2.24 L;
故答案为:盐酸不足量时:a<0.5L,4.48a L;盐酸足量时:a≥0.5L,2.24 L。


科目:高中化学 来源: 题型:
【题目】国际奥委会于2010年2月10日宣布,有30名运动员因为兴奋剂药检呈阳性,从而被取消参加2010年温哥华冬季奥运会的资格。以下是其中检测出的两种兴奋剂的结构:

关于它们的说法中正确的是( )
A.1molX与足量的NaOH溶液在常温常压下反应,最多消耗3molNaOH
B.1molX与足量的氢气反应,最多消耗2molH2
C.Y与足量的浓溴水反应,能产生白色沉淀
D.Y遇到FeCl3溶液时显紫色,但不能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行以下实验:

请填写下列空白:
(1)CCl4是____色、比水____的液体。步骤⑤后静置,下层液体的颜色为______色,上层液体的成分为___________。该步骤所用主要玻璃仪器的名称是__________。
(2)能选用CCl4获取碘的原因是_____________________、___________________、_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下面四幅图,下图叙述正确的说法有

①甲中共有5种核苷酸
②组成人体每种蛋白质的化合物乙都约为20种
③组成丙化合物的单糖是脱氧核糖
④松鼠体细胞内检测到的化合物丁很可能是蔗糖
A. 1种 B. 2种 C. 3种 D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈Ce)是一种重要的稀土金属元素,常见化合价为+3和+4,在工业上应用广泛。某课题组以回收废旧的电脑显示屏的玻璃粉(含SiO2、CeO2、Fe2O3、和FeO等)为原料,设如下工艺流程回收CeO2,并获得硫酸铁铵晶体[Fe2(SO4)32(NH4)2SO43H2O]
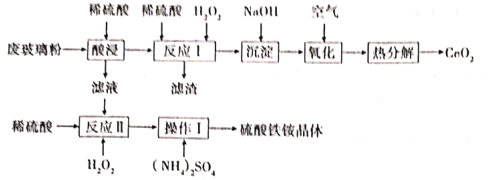
已知:①CeO2不溶于稀硫酸,也不溶于NaOH溶液;②酸浸时CeO2不反应;③“反应I”所得溶液中含有Ce3+。
试回答下列问题
(1)“滤渣”的化学式为______。
(2)在酸性条件下,H2O2、Fe3+、CeO2三种物质中,氧化性最强的是______;如将稀硫酸改为盐酸,则“酸浸”过程可能产生的大气污染物是______。
(3)“反应Ⅰ”的离子方程式为______。
(4)“氧化”反应的化学方程式为______。
(5)“操作Ⅰ”依次为:低温蒸发结晶、过滤、______常温晾干等操作。所得硫酸铁铵常用作净水剂,在去除酸性废水中的悬浮物时效率降低,原因是______。
(6)科学家利用CeO2在太阳能作用下将H2O、CO2转化成H2、CO,其过程如下:mCeO2![]() (m-x)CeO2xCe+xO2,
(m-x)CeO2xCe+xO2,
(m-x)CeO2xCe+xH2O+xCO![]() mCeO2+xH2+xCO。在该总转化过程中,CeO2作______,从能量转化的角度,该过程的重要意义是______。
mCeO2+xH2+xCO。在该总转化过程中,CeO2作______,从能量转化的角度,该过程的重要意义是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CsCl晶体的密度为ρg·cm-3,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为acm,如图所示,则CsCl的相对分子质量可以表示为( )
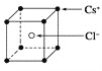
A. NA·a3·ρ B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。试回答下列问题:
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为______。
(2)金属Ni能与CO形成配合物Ni(CO)4.与CO互为等电子体的一种分子为______(写化学式,下同),与CO互为等电子体的一种离子为______。
(3)丁二酮肟(![]() )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
(4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:
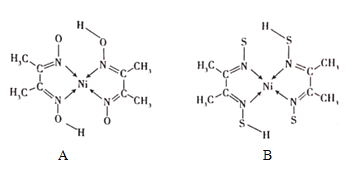
①A的熔、沸点高于B的原因为______。
②B晶体含有化学键的类型为______(填选项字母)。
A.σ键B.金属键C.配位键D.π键
(5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为______。
(6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为______。
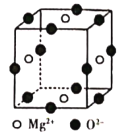
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X(5没食子酰基奎宁酸)具有抗氧化性和抗利什曼虫活性而备受关注,X的结构简式如图所示。下列有关X的说法正确的是 ( )

A. 分子式为C14H15O10
B. 分子中有四个手性碳原子
C. 1 mol X最多可与4 mol NaOH反应
D. 1 mol X最多可与4 mol NaHCO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成:

下列说法不正确的是
A. Y的分子式为C10H8O3
B. 由X制取Y的过程中可得到乙醇
C. 一定条件下,Y能发生加聚反应和缩聚反应
D. 等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为3∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com