
【题目】下列叙述中不正确的是
A.NH3分子与H+结合的过程中,N原子的杂化类型未发生改变
B.某晶体固态不导电,熔融状态能导电,可以较充分说明该晶体是离子晶体
C.区分晶体和非晶体最可靠的科学方法是对固体进行X-射线衍射实验
D.气态SO3和SO2中心原子的孤电子对数目相等
【答案】D
【解析】
NH3分子与H+结合生成NH4+;离子晶体是电解质,晶体不能导电,但水溶液或熔融状态下能导电;构成晶体的粒子在微观空间里呈现周期性的有序排列,晶体的这一结构特征可以通过X射线衍射图谱反映出来;计算中心原子的孤电子对数目: ![]() (中心原子价电子数-中心原子结合的原子数
(中心原子价电子数-中心原子结合的原子数![]() 中心原子结合的原子提供的单电子数)。
中心原子结合的原子提供的单电子数)。
A.NH3分子与H+结合生成NH4+,反应前后N原子的杂化类型均为sp3,符合题意及,故A正确;
B.离子晶体是电解质,晶体不能导电,但水溶液或熔融状态下能导电,因此,某晶体固态不导电,熔融状态能导电,可以较充分说明该晶体是离子晶体,故B正确;
C.构成晶体的粒子在微观空间里呈现周期性的有序排列,晶体的这一结构特征可以通过X射线衍射图谱反映出来。因此,区分晶体和非晶体的最可靠的科学方法是对固体进行X射线衍射实验,故C正确;
D.通过公式计算中心原子的孤电子对数,SO3:![]() 、SO2:
、SO2:![]() ,所以二者的孤电子对数目不相等;故D错误;
,所以二者的孤电子对数目不相等;故D错误;
答案选D。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】氢氧化铈[Ce(OH)4]是一种重要的稀土氢氧化物。平板电视显示屏生产过程中会产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2),某课题组以此粉末为原料回收铈,设计实验流程如下:
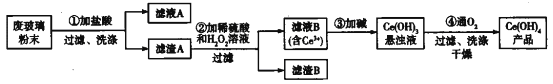
下列说法错误的是
A. 滤渣A中主要含有SiO2、CeO2
B. 过滤操作中用到的玻璃仪器有烧杯、漏斗、玻璃棒
C. 过程②中发生反应的离子方程式为CeO2+H2O2+3H+=Ce3++2H2O+O2↑
D. 过程④中消耗 11.2L O2(已折合成标准状况),转移电子数为2×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家发明了一种“可固氮”的锂-氮二次电池,将可传递Li+的醚类作电解质,电池的总反应为![]()
![]()
![]() 。下列说法正确的是
。下列说法正确的是

A. 固氮时,锂电极发生还原反应
B. 脱氮时,钌复合电极的电极反应:2Li3N-6e-=6Li++N2↑
C. 固氮时,外电路中电子由钌复合电极流向锂电极
D. 脱氮时,Li+向钌复合电极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K、Ka、Kw、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是___。
![]() 它们都能反映一定条件下对应变化进行的程度
它们都能反映一定条件下对应变化进行的程度
![]() 它们的大小都随温度的升高而增大
它们的大小都随温度的升高而增大
![]() 常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)已知25℃时CH3COOH和NH3·H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为___,溶液中离子浓度大小关系为___。
(3)氯化铝溶液蒸干、灼烧后得到的固体物质是___。
(4)泡沫灭火器的反应原理(硫酸铝溶液与小苏打)___。(写离子方程式)
(5)已知在25℃时Ksp[Mg(OH)2]=3.2×10-11,Ksp[Cu(OH)2]=2.2×10-20。25℃时,向浓度均为0.02mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成沉淀___(填化学式);当两种沉淀共存时,![]() =___。
=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列有机反应类型的认识中,不正确的是( )
A.![]() +HNO3
+HNO3![]()
![]() +H2O;取代反应
+H2O;取代反应
B.CH4+Cl2 ![]() CH3Cl + HCl ;置换反应
CH3Cl + HCl ;置换反应
C.CH2=CH2+H2O![]() CH3—CH2OH;加成反应
CH3—CH2OH;加成反应
D.CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;酯化反应
CH3COOC2H5+H2O;酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.25℃时NH4Cl溶液的Kw大于100℃时NaCl溶液的Kw
B.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
C.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
D.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图不一致的是
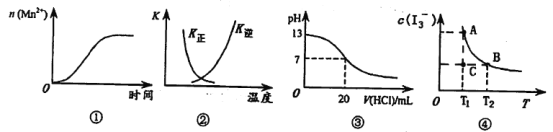
A.图①表示5 mL 0.01 mol·L-1 KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
B.图②中曲线表示反应2SO2(g)+O2(g)![]() 2SO3(g) △H<0正、逆反应的平衡常数K随温度的变化
2SO3(g) △H<0正、逆反应的平衡常数K随温度的变化
C.图③表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
D.I2在KI溶液中存在I2(aq)+I-(aq)![]() I3-(aq)的平衡,c(I3-)与温度T的关系如图④,若反应进行到状态C时,一定有V(正)>V(逆)
I3-(aq)的平衡,c(I3-)与温度T的关系如图④,若反应进行到状态C时,一定有V(正)>V(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:

下列说法正确的是
A.甲池通入O2的电极反应为O2 + 4e-+ 4H+=2H2O
B.乙池 Ag电极增重6.4g,溶液中将转移0.2mol电子
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余电解质溶液中加入适量相应的溶质能使溶液恢复到电解前浓度的是
A. AgNO3 B. Na2SO4 C. CuCl2 D. KCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com