
【题目】用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余电解质溶液中加入适量相应的溶质能使溶液恢复到电解前浓度的是
A. AgNO3 B. Na2SO4 C. CuCl2 D. KCl
【答案】C
【解析】试题分析:四种电解类型分别是:
(1)分解水型:含氧酸、强碱、活泼金属的含氧酸盐(如NaOH、H2SO4、K2SO4等)的电解。
阴极:4H++4e-=2H2↑ 阳极:4OH--4e-=O2↑+2H2O 总反应:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
阴极产物:H2;阳极产物:O2。 电解质溶液复原加入物质:H2O。
pH变化情况:原来酸性的溶液pH变小,原来碱性的溶液pH变大,强酸(含氧酸)强碱的正盐溶液pH不变。
(2)分解电解质型:无氧酸(除HF外)、不活泼金属的无氧酸盐(氟化物除外)的电解,如HCl、CuCl2等。
阴极:Cu2++2e-=Cu 阳极:2Cl--2e-=Cl2↑ 总反应:CuCl2![]() Cu+Cl2↑
Cu+Cl2↑
阴极产物:酸为H2,盐为金属;阳极产物:卤素等非金属单质。
电解液复原加入物质为原溶质,如电解CuCl2溶液,需加CuCl2。
pH变化情况:如电解无氧酸溶液pH变大但不会超过7;如为盐溶液的电解则视无氧酸根的情况而定。
(3)放氢生碱型:活泼金属的无氧酸盐(氟化物除外)溶液的电解,如NaCl、MgBr2等。
阴极:2H++2e-=H2↑ 阳极:2Cl--2e-=Cl2↑ 总反应:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
阴极产物:碱和H2;阳极产物:卤素等非金属单质。电解饱和食盐水的产物分别为NaOH和H2以及Cl2。
电解液复原加入物质为卤化氢。电解饱和食盐水,要使电解质溶液复原需加入HCl。
pH变化情况:电解液pH显著变大
(4)放氧生酸型:不活泼金属的含氧酸盐溶液的电解,如CuSO4、AgNO3等。
阴极:2Cu2++4e-=Cu 阳极:4OH--4e-=O2↑+2H2O 总反应:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
阴极产物:析出不活泼金属单质;阳极产物是该盐对应的含氧酸和氧气,本例中分别是Cu以及H2SO4、O2.
电解液复原加入物质为不活泼金属的氧化物(金属价态与原盐中相同)。如电解CuSO4溶液,复原需加入CuO。
pH变化情况:溶液pH显著变小。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】我们的生活离不开铁元素。从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是______(填化学式)。
(2)现代利用铁的氧化物循环裂解水制氢气的过程如下图所示。
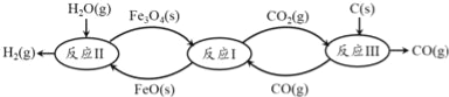
①已知:3FeO(s)+CO2(g)![]() Fe3O4(s)+CO(g)△H1═ —19.3kJmol﹣1
Fe3O4(s)+CO(g)△H1═ —19.3kJmol﹣1
Fe3O4(s)+H2(g)![]() 3FeO(s)+H2O(g)△H2═+57.2kJmol﹣1
3FeO(s)+H2O(g)△H2═+57.2kJmol﹣1
C(s)+CO2(g)![]() 2CO(g)△H3═ +172.4kJmol﹣1
2CO(g)△H3═ +172.4kJmol﹣1
铁氧化物循环裂解水制氢气总反应的热化学方程式是
C(s)+H2O(g)═H2(g)+CO(g)△H═_____________ 。
②整个过程与温度密切相关,当温度低于570℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行。下图表示其他条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度的变化关系。

i.反应Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g)△H______0(填“>”、“<”或“=”),理由是______。
3Fe(s)+4CO2(g)△H______0(填“>”、“<”或“=”),理由是______。
ii.在低于570℃的某温度时,发生上述反应,增加CO浓度,C(CO)/C(CO2)比值_______(填“增大”“减小”“不变”)。
(3)①18世纪有一个名叫狄斯巴赫的德国人,他是制造和使用涂料的工人,因此对各种有颜色的物质都感兴趣。他实验合成出古老而神奇的蓝色染料普鲁士蓝。他的合成方法如下:
复分解反应ii的化学方程式为______。
②利用普鲁士蓝合成原理也可以用于检测食品中CN﹣,通过试纸变蓝与否则证明食品中含有CN﹣,检测过程方案如下:
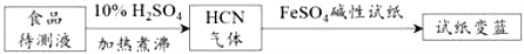
FeSO4碱性试纸用于检测HCN的工作原理为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 物质的实验式就是其分子式
B. 质谱法可以测定物质的相对分子质量
C. 从物质的红外光谱图可以获得分子中含有化学键或官能团的信息
D. 从1H核磁共振谱图可以推知该有机物分子有几种不同类型氢原子及其数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是常见实验仪器或装置。请回答下列问题
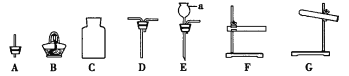
(1)仪器a的名称是__________。
(2)利用高锰酸钾制取并收集O2应选仪器__________(填序号),发生反应的化学方程式为__________。装入药品后,应__________,再塞上橡皮塞,收集氧气时,气体应从D的__________端通入。
(3)用CO还原Fe2O3并检验生成的气体产物,应选仪器__________(填序号);加热前应__________,目的是__________,然后用酒精灯预热,再对准固体加热。处理尾气的方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《天工开物》中记载:…属草木者为枲、麻、苘、葛,属禽兽与昆虫者裘褐、丝绵…。文中的“枲、麻、苘、葛”和“裘褐、丝绵”分别属于( )
A.纤维素、油脂B.糖类、油脂
C.糖类、蛋白质D.纤维素、蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将100 mL的NaOH和Ba(OH)2混合碱溶液分成两等份,一份加入过量的Na2SO4溶液,充分反应后得到沉淀2.33 g;另一份加入50 mL0.1 mol/LH2SO4溶液,充分反应后溶液中c(OH-)为0.3 mol/L(此时溶液的体积为100 mL),试计算:
(1)原混合碱溶液中所含Ba(OH)2的物质的量是________。
(2)原混合溶液中NaOH的物质的量浓度是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定能在下列溶液中大量共存的离子组为( )
A.含有大量Fe2+的溶液:Na+、NH4+、ClO﹣、SO42﹣
B.含有大量氨水的溶液:Ca2+、Mg2+、Ba2+、NO3﹣
C.含有大量AlO2﹣的溶液:Na+、K+、NO3﹣、CO32﹣
D.含有大量NO3﹣的溶液:H+、I﹣、SO42﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有酚类、重金属、氰类、三氯甲烷及砷类等有害物质,必须处理后才可排放。
(1)用FeS除去废水中重金属汞盐的反应为Hg2++FeS![]() HgS + Fe2+,该反应的平衡常数为K=____________ [填数值,已知:Ksp(FeS)=6.4×10-15,Ksp(HgS)=1.6×10-52]。
HgS + Fe2+,该反应的平衡常数为K=____________ [填数值,已知:Ksp(FeS)=6.4×10-15,Ksp(HgS)=1.6×10-52]。
(2)处理含CN-废水有惰性电极电解法、NaClO氧化法等。
已知:HCN的Ka=6.3×10-10,沸点为25.7℃,有剧毒。
①电解前需将废水的pH调至10~11,其目的是___________。
②惰性电极电解时,CN-在阳极最终氧化为CO32-、CO2和N2。则1mol CN-在阳极被完全氧化,同时在阴极上产生H2的物质的量为___________(不考虑副反应)。
③电解后期需在废水中加入食盐继续电解,加食盐除可提高电流效率外,还因为___________。
(3)纳米零价铁除去酸性废水中的三氯乙烯、五价砷的原理如下图所示:

纳米零价铁中Fe为负极, C2HCl3在其表面被还原的电极反应式为___________;在含高浓度SO42-的酸性溶液中脱除砷的化学方程式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com