
【题目】工业废水中常含有酚类、重金属、氰类、三氯甲烷及砷类等有害物质,必须处理后才可排放。
(1)用FeS除去废水中重金属汞盐的反应为Hg2++FeS![]() HgS + Fe2+,该反应的平衡常数为K=____________ [填数值,已知:Ksp(FeS)=6.4×10-15,Ksp(HgS)=1.6×10-52]。
HgS + Fe2+,该反应的平衡常数为K=____________ [填数值,已知:Ksp(FeS)=6.4×10-15,Ksp(HgS)=1.6×10-52]。
(2)处理含CN-废水有惰性电极电解法、NaClO氧化法等。
已知:HCN的Ka=6.3×10-10,沸点为25.7℃,有剧毒。
①电解前需将废水的pH调至10~11,其目的是___________。
②惰性电极电解时,CN-在阳极最终氧化为CO32-、CO2和N2。则1mol CN-在阳极被完全氧化,同时在阴极上产生H2的物质的量为___________(不考虑副反应)。
③电解后期需在废水中加入食盐继续电解,加食盐除可提高电流效率外,还因为___________。
(3)纳米零价铁除去酸性废水中的三氯乙烯、五价砷的原理如下图所示:

纳米零价铁中Fe为负极, C2HCl3在其表面被还原的电极反应式为___________;在含高浓度SO42-的酸性溶液中脱除砷的化学方程式为___________。
【答案】 4×1037 防止生成HCN,污染空气并造成人员中毒 2.5mol 阳极上生成的Cl2及溶液中产生的ClO-可氧化CN- C2HCl3+5H++8e-=C2H6 + 3Cl- 14Fe2++SO42-+AsO3-+14H+ = FeAsS↓+13Fe3++7H2O
【解析】(1)用FeS除去废水中汞盐的反应为Hg2++FeS![]() HgS + Fe2+,该反应的平衡常数为K=
HgS + Fe2+,该反应的平衡常数为K=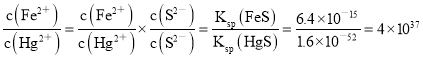 ;(2)①HCN的Ka=6.3×10-10,沸点为25.7℃,有剧毒,电解前需将废水的pH调至10~11,其目的是防止生成HCN,污染空气并造成人员中毒;②惰性电极电解时,CN-在阳极最终氧化为CO32-、CO2和N2。电极反应:4OH--4e-=2H2O+O2↑,4CN-+5O2=2CO32-+2CO2↑+2N2 ↑,1mol CN-在阳极被完全氧化,需要5/4molO2,电子转移为5mol,电子守恒,阴极电极反应为2H++2e-=H2↑,在阴极上产生H2的物质的量2.5mol。③电解后期需在废水中加入食盐继续电解,加食盐除可提高电流效率外,阳极生成的氯气和溶液中生成次氯酸盐可以氧化CN-离子;(3)纳米零价铁中Fe为负极,由图可知C2HCl3在其表面被还原为乙烷,据电荷守恒、原子守恒,电极反应为:C2HCl3+5H++8e-=C2H6+3Cl-,据图可判断亚铁离子还原AsO3-,因此在酸性溶液中脱除砷,反应的离子方程式为:14Fe2++SO42-+AsO3-+14H+ = FeAsS↓+13Fe3++7H2O。
;(2)①HCN的Ka=6.3×10-10,沸点为25.7℃,有剧毒,电解前需将废水的pH调至10~11,其目的是防止生成HCN,污染空气并造成人员中毒;②惰性电极电解时,CN-在阳极最终氧化为CO32-、CO2和N2。电极反应:4OH--4e-=2H2O+O2↑,4CN-+5O2=2CO32-+2CO2↑+2N2 ↑,1mol CN-在阳极被完全氧化,需要5/4molO2,电子转移为5mol,电子守恒,阴极电极反应为2H++2e-=H2↑,在阴极上产生H2的物质的量2.5mol。③电解后期需在废水中加入食盐继续电解,加食盐除可提高电流效率外,阳极生成的氯气和溶液中生成次氯酸盐可以氧化CN-离子;(3)纳米零价铁中Fe为负极,由图可知C2HCl3在其表面被还原为乙烷,据电荷守恒、原子守恒,电极反应为:C2HCl3+5H++8e-=C2H6+3Cl-,据图可判断亚铁离子还原AsO3-,因此在酸性溶液中脱除砷,反应的离子方程式为:14Fe2++SO42-+AsO3-+14H+ = FeAsS↓+13Fe3++7H2O。


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余电解质溶液中加入适量相应的溶质能使溶液恢复到电解前浓度的是
A. AgNO3 B. Na2SO4 C. CuCl2 D. KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面关于摩尔质量的描述或应用中正确的是
A. 一个钠原子的质量等于![]() g B. 二氧化碳的摩尔质量是44 g
g B. 二氧化碳的摩尔质量是44 g
C. 铁原子的摩尔质量等于它的相对原子质量 D. 1 mol氢氧根离子的质量是17
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中粒子浓度关系的叙述正确的是( )
A. 0.1 mol·L1 NH4NO3溶液中:c(![]() )>c(
)>c(![]() )>c(H+)>c(OH)
)>c(H+)>c(OH)
B. 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO)=c(CO32)+c(HCO3)+c(H2CO3)
C. 向10 mL 0.2 mol·L1 NaCl溶液中滴入2 mL 0.1 mol·L1 AgNO3溶液,溶液中离子浓度大小关系:c(Na+)>c(![]() )=c(Cl)>c(Ag+)
)=c(Cl)>c(Ag+)
D. 常温下pH=2的醋酸与pH=12的烧碱溶液等体积混合:c(Na+)>c(CH3COO)>c(OH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
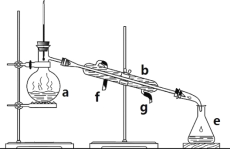
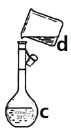
I II
(1)写出下列仪器的名称:a.____________;b. ___________;c. ___________。
(2)仪器c使用前必须__________________。
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,温度计水银球的位置在______________________处。冷凝水由_____(填f或g)口通入______口流出。
(4)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。①图中的错误是____________。除了图中给出的的仪器和托盘天平外,为完成实验还需要的仪器有:_____________。②根据计算得知,所需NaOH的质量为_______g。③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)________。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,反复颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(5)操作A中,将洗涤液都移入容量瓶,其目的是_________________________________,溶液注入容量瓶前需恢复到室温,这是因为_______________________________;
(6)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作_______________;若加蒸馏水时不慎超过了刻度线_______________;若定容时俯视刻度线________;若配制完成后发现砝码和药品颠倒了,则结果______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在体积可变的密闭容器中充入4molCO和8molH2,在催化剂作用下合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:
CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:

①该反应的逆反应属于________反应;(填“吸热”或“放热”)。
②在0.1Mpa 、100℃的条件下,该反应达到平衡时容器体积为开始容器体积的_________倍。(结果保留两位小数点)
③在温度和容积不变的情况下,再向平衡体系中充入4molCO,达到平衡时CO转化率________(填“增大”,“不变”或“减小”),平衡常数K________(填“增大”,“不变”或“减小”)。
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
①CH4(g)+ H2O(g)= CO(g)+3H2(g) △H=+206.2 kJ·mol-1
②CH4(g)+ CO2(g)= 2CO(g)+2H2(g) △H=+247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
(3)在反应(Ⅰ)中制得的CH3OH 即可以做燃料,还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液。则该燃料电池放电时:负极的电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是
①20 mL 0.01 mol/L KCl溶液 ②30 mL 0.02 mol/L CaCl2溶液
③40 mL 0.03 mol/L HCl溶液 ④10 mL 蒸馏水⑤50 mL 0.05 mol/L AgNO3溶液
A. ①>②>③>④>⑤ B. ④>①>③>②>⑤
C. ⑤>④>②>①>③ D. ④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Cl2+2Fe2+=2Cl-+2Fe3+的离子反应中,Fe2+代表的化合物不可以是( )
①Fe(OH)2 ②FeCl2 ③FeSO4 ④FeCO3
A.①④B.①③C.①③④D.②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普罗帕酮是广谱高效抗心律失常的药物,它由有机物X经多步反应合成的过程如下:

下列说法正确的是( )
A. 普罗帕酮的分子式为C19H24NO3
B. X,Y的核磁共振氢谱图中都有4组特征峰
C. 含少量X与Y的普罗帕酮可用烧碱溶液进行提纯
D. 一定条件下,X、Y和普罗帕酮都能发生加成、取代、水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com