
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
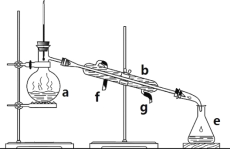
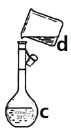
I II
(1)写出下列仪器的名称:a.____________;b. ___________;c. ___________。
(2)仪器c使用前必须__________________。
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,温度计水银球的位置在______________________处。冷凝水由_____(填f或g)口通入______口流出。
(4)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。①图中的错误是____________。除了图中给出的的仪器和托盘天平外,为完成实验还需要的仪器有:_____________。②根据计算得知,所需NaOH的质量为_______g。③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)________。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,反复颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(5)操作A中,将洗涤液都移入容量瓶,其目的是_________________________________,溶液注入容量瓶前需恢复到室温,这是因为_______________________________;
(6)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作_______________;若加蒸馏水时不慎超过了刻度线_______________;若定容时俯视刻度线________;若配制完成后发现砝码和药品颠倒了,则结果______________。
【答案】蒸馏烧瓶冷凝管容量瓶检查是否漏水酒精灯与蒸馏烧瓶支管口相平gf未用玻璃棒引流药匙、胶头滴管 、玻璃棒2.0gB→C→A→F→E→D将剩余的氢氧化钠全部转移到容量瓶中溶液体积热胀冷缩,导致溶液浓度有偏差偏低偏低偏高无影响
【解析】
(1)根据仪器的结构特征判断仪器的名称;(2)容量瓶在使用前一定要查漏;(3)分离四氯化碳和酒精的混合物的过程必须用酒精灯加热,实质是蒸馏过程,冷凝管下口是进水口,上口是出水口;(4)根据配制一定物质的量浓度的溶液的方法和操作来寻找装置中的错误,并判断使用仪器和操作步骤。
(1)蒸馏装置中的主要仪器有蒸馏烧瓶、冷凝管、牛角管、锥形瓶,酒精灯,a为蒸馏烧瓶,b为冷凝管,c为容量瓶,为配制溶液的主要仪器,故答案为:蒸馏烧瓶;冷凝管; 容量瓶;
(2)仪器c为容量瓶,在使用前一定要检查是否漏水;
(3)分离四氯化碳和酒精的混合物的实质是蒸馏过程,必须用酒精灯,温度计应与位于蒸馏烧瓶支管口相平,冷凝管下口是进水口,上口是出水口,故答案为:酒精灯;与位于蒸馏烧瓶支管口相平; g;f;
(4)①配制一定物质的量浓度的溶液是必须用玻璃棒引流,防止液体外溅,并且当滴加到离刻度线1~2cm时改用胶头滴管滴加液体,故答案为:未用玻璃棒引流;药匙、玻璃棒、胶头滴管;
②实验室没有450mL的容量瓶,应配制500mL,则需n(NaOH)=0.1mol/L×0.5L=0.05mol,m(NaOH)=0.05mol×40g/mol=2.0g;
③配制溶液5000mL,配制步骤有量取、稀释、移液、洗涤移液、定容、摇匀等操作,用托盘天平称量2.0gNaOH,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤,并将洗涤液移入容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,所以操作顺序为BCAFED;
(5)把洗涤液转移到容量瓶中,目的是将剩余的氢氧化钠全部转移到容量瓶中,减少误差,NaOH遇水放出大量的热,因为热胀冷缩,恢复到室温状态下,溶液的体积会减小,所配溶液溶度会偏大;
(6)没有洗涤,容量瓶中溶质的物质的量减少,因此所配溶液的浓度偏低,加蒸馏水超过刻度线,相当于对原溶液进行稀释,因此所配溶液的浓度偏低,定容时俯视刻度线,溶液的体积低于刻度线,所配溶液的浓度偏高;若配制完成后发现砝码和药品颠倒了,因此次称量的氢氧化钠固体的质量为2.0g,没有用到游码,则结果所配溶液浓度无影响。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】《天工开物》中记载:…属草木者为枲、麻、苘、葛,属禽兽与昆虫者裘褐、丝绵…。文中的“枲、麻、苘、葛”和“裘褐、丝绵”分别属于( )
A.纤维素、油脂B.糖类、油脂
C.糖类、蛋白质D.纤维素、蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知pC=-lgc;Ksp[Cu(OH)2]=2.2×10-20和Ksp[Mg(OH)2]=1.8×10-11,测得两种金属离子的PC与pH的变化关系如下图所示。下列说法正确的是

A. 加入氨水调节pH可除去MgS04溶液中的CuSO4杂质
B. pH调到Q点则Mg2+和Cu2+都已沉淀完全
C. 在浓度均为1mo/LCuSO4和MgS04的混合溶液中,存在c(Cu2+)+c(Mg2+)>c(S042-)
D. L1代表pC(Cu2+)随pH变化,L2代表pC(Mg2+)随pH变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铂电极电解下表中各组物质的稀溶液(如图)一段时间后,甲、乙两池中溶液的pH均碱小,且在①和④两极的电极产物的物质的量之比为1:2的是( )

A | B | C | D | |
甲 | KOH | H2SO4 | Na2SO4 | CuSO4 |
乙 | CuSO4 | AgNO3 | HCl | HNO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g H2完全燃烧生成水蒸气时放出热量121 kJ,且O2中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则H2中1 mol H—H键断裂时吸收热量为( )
A. 920 kJ B. 557 kJ C. 188kJ D. 436 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有酚类、重金属、氰类、三氯甲烷及砷类等有害物质,必须处理后才可排放。
(1)用FeS除去废水中重金属汞盐的反应为Hg2++FeS![]() HgS + Fe2+,该反应的平衡常数为K=____________ [填数值,已知:Ksp(FeS)=6.4×10-15,Ksp(HgS)=1.6×10-52]。
HgS + Fe2+,该反应的平衡常数为K=____________ [填数值,已知:Ksp(FeS)=6.4×10-15,Ksp(HgS)=1.6×10-52]。
(2)处理含CN-废水有惰性电极电解法、NaClO氧化法等。
已知:HCN的Ka=6.3×10-10,沸点为25.7℃,有剧毒。
①电解前需将废水的pH调至10~11,其目的是___________。
②惰性电极电解时,CN-在阳极最终氧化为CO32-、CO2和N2。则1mol CN-在阳极被完全氧化,同时在阴极上产生H2的物质的量为___________(不考虑副反应)。
③电解后期需在废水中加入食盐继续电解,加食盐除可提高电流效率外,还因为___________。
(3)纳米零价铁除去酸性废水中的三氯乙烯、五价砷的原理如下图所示:

纳米零价铁中Fe为负极, C2HCl3在其表面被还原的电极反应式为___________;在含高浓度SO42-的酸性溶液中脱除砷的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验报告中记录下列数据,其中正确的是
A. 用 100 mL 量筒量取 12.5 mL 盐酸
B. 称量 NaOH 固体时,将 NaOH 直接放在托盘上的纸上
C. 需用 220 mL, 1 mol·L-1 CuSO4 溶液,配制时需称 62.5g 的 CuSO4·5H2O 晶体
D. 配制稀硫酸时,先向烧杯中注入浓硫酸,再加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为_____,物质的量之比为_____,质量之比为_____。
(2)等质量的 SO2 和 SO3 物质的量之比是_____,氧原子数之比为_____。
(3)19 g 某二价金属的氯化物 ACl2 中含有 0.4mol Cl-,则 A 的摩尔质量为_____。
(4)密度为 1.84 g/cm3,质量分数为 98%的浓硫酸浓度为_____mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________________mol。
(2)该气体所含原子总数为________________个。
(3)该气体在标准状况下的体积为_________________L。
(4)该气体在标准状况下的密度为_______________ g/L。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_______mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com