
【题目】已知pC=-lgc;Ksp[Cu(OH)2]=2.2×10-20和Ksp[Mg(OH)2]=1.8×10-11,测得两种金属离子的PC与pH的变化关系如下图所示。下列说法正确的是

A. 加入氨水调节pH可除去MgS04溶液中的CuSO4杂质
B. pH调到Q点则Mg2+和Cu2+都已沉淀完全
C. 在浓度均为1mo/LCuSO4和MgS04的混合溶液中,存在c(Cu2+)+c(Mg2+)>c(S042-)
D. L1代表pC(Cu2+)随pH变化,L2代表pC(Mg2+)随pH变化
【答案】D
【解析】A、加入氨水调节pH可使Cu2+生成沉淀与Mg2+分离,但引入了新的杂质离子NH4+,所以A错误;B、Q点的pH约为9,则由Ksp求得c(Cu2+)=![]() 10—10 mol/L<1.0
10—10 mol/L<1.0![]() 10—5 mol/L,c(Mg2+)=
10—5 mol/L,c(Mg2+)=![]() 10—2 mol/L>1.0
10—2 mol/L>1.0![]() 10—5 mol/L,所以Cu2+已沉淀完全而Mg2+不能沉淀完全,故B错误;C、由于Mg2+和Cu2+都能够水解,所以c(Cu2+)+c(Mg2+)<c(S042-),则C错误;D、由图象可知,当Mg2+和Cu2+的浓度均为1mol/L时开始生成Cu(OH)2沉淀的pH为4左右,而开始生成Mg(OH)2沉淀的pH为9左右,所以D正确。本题正确答案为D。
10—5 mol/L,所以Cu2+已沉淀完全而Mg2+不能沉淀完全,故B错误;C、由于Mg2+和Cu2+都能够水解,所以c(Cu2+)+c(Mg2+)<c(S042-),则C错误;D、由图象可知,当Mg2+和Cu2+的浓度均为1mol/L时开始生成Cu(OH)2沉淀的pH为4左右,而开始生成Mg(OH)2沉淀的pH为9左右,所以D正确。本题正确答案为D。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】氢气是重要的化工原料,甲烷和水蒸气在高温和催化剂存在的条件下生成一氧化碳和氢气,工业上称为“甲烷蒸气转化法”。
(1)已知有关反应的能量变化如下图:
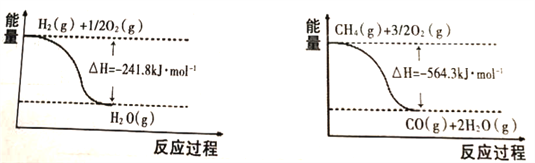
则甲烷和水蒸气反应生成一氧化碳和氢气的热化学方程式为_______________________________;
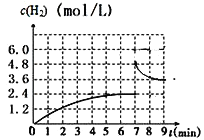
(2)已若该反应在700℃,1 MPa时,1 mol CH4与1 mol H2O在1 L的密闭容器中反应,反应中氢气浓度随时间的变化如右图,6min达到平衡。该温度下反应的平衡常数为______________(结果保留小数点后一位数字)。由第一次平衡到第二次平衡,平衡移动的方向是_____________,采取的措施可能是___________________。
(3)右图中a、b、c、d四条曲线中的两条代表压强分别为1Mpa、2Mpa时甲烷含量曲线,其中表示1Mpa的是________(填字母)。
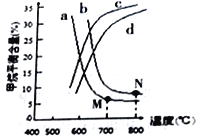
在实际生产中采用图中M点而不是N 点对应的反应条件,运用化学反应速率和平衡知识,同时考虑实际生产,说明选择该反应条件的主要原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加碘食盐中碘元素以KIO3形式存在,KIO3是一种白色粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质。某化学兴趣小组对加碘食盐中的KIO3含量进行探究。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取wg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI 溶液;
c.以淀粉为指示剂,用物质的量浓度为1.0×10-3mol/L的Na2S2O3溶液进行滴定 (滴定时的反应方程式: I2+2S2O32-=2I-+S4O62-)。
操作b 涉及的主要反应的离子方程式为_____;滴定时,Na2S2O3溶液应放在_____(填“酸式滴定管”或“碱式滴定管”),滴定至终点时消耗Na2S2O3溶液20.00 mL,其终点颜色变化为________;加碘食盐样品中的碘元素含量是________mg/kg (以含w的代数式表示)。
(2) 学生乙对纯净的NaCl (不含KIO3 )进行了下列实验:
顺序 | 步骤 | 实验现象 |
① | 取少量纯净的NaCl,加蒸馏水溶解 | 溶液无变化 |
② | 滴入淀粉-KI溶液,振荡 | 溶液无变化 |
③ | 放置片刻,再滴加稀H2SO4,振荡 | 溶液变蓝色 |
请推测实验③中产生蓝色现象的可能原因是(用离子方程式表示):________。由学生乙的实验结果推知,学生甲的实验结果将_______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面关于摩尔质量的描述或应用中正确的是
A. 一个钠原子的质量等于![]() g B. 二氧化碳的摩尔质量是44 g
g B. 二氧化碳的摩尔质量是44 g
C. 铁原子的摩尔质量等于它的相对原子质量 D. 1 mol氢氧根离子的质量是17
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G[ ]是一种医药中间体,它的一种合成路线如下:
]是一种医药中间体,它的一种合成路线如下:

已知:
请回答下列问题:
(1)A的名称是_____________。
(2)B→C的反应条件为_____________。
A→B和D→E的反应类型分别是_____________、_____________。
(3)D在浓硫酸加热的条件下会生成一种含六元环的化合物,该化合物的结构简式为_____________。(4)H是一种高聚酯,D→H的化学方程式为_____________。
(5)下列关于化合物G的说法错误的是_____________。
A.G的分子式为C12H14O5
B.1molG与NaOH溶液加热最多消耗2molNaOH
C.一定条件下G发生消去反应生成的有机物存在顺反异构体
D.在一定条件下G能与HBr发生取代反应
(6)M是D的同分异构体,与D具有相同的官能团。则M可能的结构有____种。
(7)已知酚羟基不易与羧酸发生酯化反应,写出由苯酚,甲苯为原料制备苯甲酸苯酚酯(![]() )的合成路线(其它试剂任选)。 __________________
)的合成路线(其它试剂任选)。 __________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
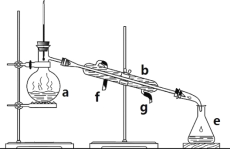
I II
(1)写出下列仪器的名称:a.____________;b. ___________;c. ___________。
(2)仪器c使用前必须__________________。
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,温度计水银球的位置在______________________处。冷凝水由_____(填f或g)口通入______口流出。
(4)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。①图中的错误是____________。除了图中给出的的仪器和托盘天平外,为完成实验还需要的仪器有:_____________。②根据计算得知,所需NaOH的质量为_______g。③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)________。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,反复颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(5)操作A中,将洗涤液都移入容量瓶,其目的是_________________________________,溶液注入容量瓶前需恢复到室温,这是因为_______________________________;
(6)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作_______________;若加蒸馏水时不慎超过了刻度线_______________;若定容时俯视刻度线________;若配制完成后发现砝码和药品颠倒了,则结果______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要用 NaOH 固体配制 80mL 1.00mol·L-1 的 NaOH 溶液,试回答下列各题:
(1)人们常将配制过程简述为以下各步骤:
A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移溶液 其正确的操作顺序应是_____________________(填各步骤序号)。
(2)在称量时,用托盘天平准确称量_____g 固体 NaOH;
(3)本实验必须用到的仪器有天平、药匙、烧杯、玻璃棒,还需要的仪器是_____。
(4)定容的操作要点是:__________。
(5) 配置过程中,以下操作会使 NaOH 溶液物质的量浓度偏高的是_____。
A.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
B.定容时俯视刻度线
C.往容量瓶转移时,有少量 NaOH 液体溅出
D.容量瓶未干燥即用来配制溶液
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
F.向容量瓶中转移溶液时,未等溶液冷却就进行定容
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com