
【题目】氢气是重要的化工原料,甲烷和水蒸气在高温和催化剂存在的条件下生成一氧化碳和氢气,工业上称为“甲烷蒸气转化法”。
(1)已知有关反应的能量变化如下图:
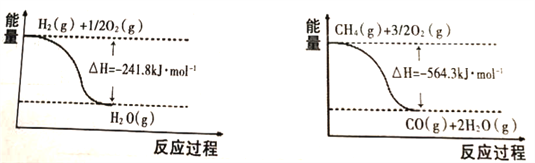
则甲烷和水蒸气反应生成一氧化碳和氢气的热化学方程式为_______________________________;
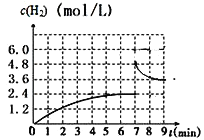
(2)已若该反应在700℃,1 MPa时,1 mol CH4与1 mol H2O在1 L的密闭容器中反应,反应中氢气浓度随时间的变化如右图,6min达到平衡。该温度下反应的平衡常数为______________(结果保留小数点后一位数字)。由第一次平衡到第二次平衡,平衡移动的方向是_____________,采取的措施可能是___________________。
(3)右图中a、b、c、d四条曲线中的两条代表压强分别为1Mpa、2Mpa时甲烷含量曲线,其中表示1Mpa的是________(填字母)。
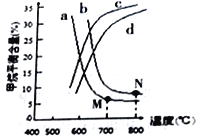
在实际生产中采用图中M点而不是N 点对应的反应条件,运用化学反应速率和平衡知识,同时考虑实际生产,说明选择该反应条件的主要原因是________________________________。
【答案】 CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH=+161.1kJ/mol 276.5mol2·L-2 逆反应方向 反应体积减小一半或加入等量H2 a 压强越小越有利于该反应向正反应方向进行,有利于提高转化率,同时降低了增大压强的成本;温度越低越有利于该反应向正反应方向进行,CH4转化率大,700℃催化剂活性温度,反应的速率快;所以M 点较为合适。
CO(g)+3H2(g) ΔH=+161.1kJ/mol 276.5mol2·L-2 逆反应方向 反应体积减小一半或加入等量H2 a 压强越小越有利于该反应向正反应方向进行,有利于提高转化率,同时降低了增大压强的成本;温度越低越有利于该反应向正反应方向进行,CH4转化率大,700℃催化剂活性温度,反应的速率快;所以M 点较为合适。
【解析】(1)由图1可知:①H2(g)+![]() O2(g)→H2O(g)△H=-241.8kJ/mol;②CH4(g)+
O2(g)→H2O(g)△H=-241.8kJ/mol;②CH4(g)+![]() O2(g)→CO(g)+2H2O(g)△H=-564.3kJ/mol;由盖斯定律可知,②-3×①得CH4(g)+H2O(g)
O2(g)→CO(g)+2H2O(g)△H=-564.3kJ/mol;由盖斯定律可知,②-3×①得CH4(g)+H2O(g)![]() CO2(g)+3H2(g)△H=-564.3kJ/mol-3×(-241.8kJ/mol)=+161.1kJ/mol,故答案为:CH4(g)+H2O(g)
CO2(g)+3H2(g)△H=-564.3kJ/mol-3×(-241.8kJ/mol)=+161.1kJ/mol,故答案为:CH4(g)+H2O(g)![]() CO2(g)+3H2(g)△H=+161.1kJ/mol;
CO2(g)+3H2(g)△H=+161.1kJ/mol;
(2) CH4(g)+H2O(g)![]() CO2(g)+3H2(g)
CO2(g)+3H2(g)
起始(mol/L): 1 1 0 0
变化(mol/L):0.8 0.8 0.8 2.4
平衡(mol/L):0.2 0.2 0.8 2.4
该温度下反应的平衡常数K=![]() =276.5mol2L-2;由图可知,在7min时,氢气的浓度增大了一倍,可能是缩小体积为原来的
=276.5mol2L-2;由图可知,在7min时,氢气的浓度增大了一倍,可能是缩小体积为原来的![]() 或增加了等量的氢气,无论是增大压强,还是增大氢气的浓度,平衡均是逆向移动,故答案为:276.5mol2L-2;向逆反应方向;将容器体积缩小为原来的
或增加了等量的氢气,无论是增大压强,还是增大氢气的浓度,平衡均是逆向移动,故答案为:276.5mol2L-2;向逆反应方向;将容器体积缩小为原来的![]() 或加入等量的氢气;
或加入等量的氢气;
(3)由CH4(g)+H2O(g)=CO2(g)+3H2(g)△H=+161.1kJ/mol可知,随着温度的升高,平衡向正反应方向移动,甲烷的平衡含量会逐渐减小,因此排除曲线c、d,又因增大压强,平衡逆向移动,甲烷的平衡含量增大,故1Mpa是曲线a,2Mpa的是曲线b;压强越小越有利于该反应向正反应方向进行,有利于提高转化率,同时降低了增大压强的成本;温度越低越有利于该反应向正反应方向进行,CH4转化率大,700℃催化剂活性温度,反应的速率快;所以实际生产中采用图中M点而不是N点,故答案为:a;压强越小越有利于该反应向正反应方向进行,有利于提高转化率,同时降低了增大压强的成本;温度越低越有利于该反应向正反应方向进行,CH4转化率大,700℃催化剂活性温度,反应的速率快。


科目:高中化学 来源: 题型:
【题目】完成下列方程式:
(1)溴乙烷与氢氧化钠的水溶液共热________________________________。
(2)乙醛与新制的银氨溶液水浴加热________________________________。
(3)纤维素在酸或酶的作用下水解__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二烯烃C5H8在工业生产中可用于生产生物降解塑料PHB (![]() ),其转化关系如下:
),其转化关系如下:
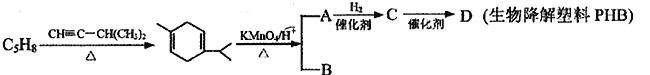
已知:①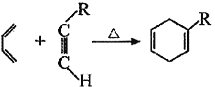
②![]()
③同一个碳原子上不能同时连接两个碳碳双键
请回答:
(1)用系统命名法给二烯烃C5H8命名为__________________,写出该二烯烃的高聚物的反式结构_____________________。
(2)A→C的反应类型为_____________________。
(3)B的结构简式为__________________,所含官能团的名称为_____________________。
(4)C→D的化学反应方程式为____________________________________。
(5)写出符合下列条件的A 的同分异构体的结构简式_____________________。
①与新制的Cu(OH)2发生反应,生成砖红色沉淀;
②与NaHCO3溶液反应产生CO2气体;
③无支链。
(6)参考题中信息,设计由![]() 和H3C-C
和H3C-C![]() C-CH3为主要有机原料合成
C-CH3为主要有机原料合成![]() 的路线流程图(无机试剂任选)_______,合成路线流程图示例如下:
的路线流程图(无机试剂任选)_______,合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《天工开物》中记载:…属草木者为枲、麻、苘、葛,属禽兽与昆虫者裘褐、丝绵…。文中的“枲、麻、苘、葛”和“裘褐、丝绵”分别属于( )
A.纤维素、油脂B.糖类、油脂
C.糖类、蛋白质D.纤维素、蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在250mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。取此溶液20mL,用水稀释至100 mL,稀释后该硫酸盐的物质的量浓度为
A.2 mol·L﹣1 B.0.4 mol·L﹣1 C.0.8 mol·L﹣1 D.1.2mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将100 mL的NaOH和Ba(OH)2混合碱溶液分成两等份,一份加入过量的Na2SO4溶液,充分反应后得到沉淀2.33 g;另一份加入50 mL0.1 mol/LH2SO4溶液,充分反应后溶液中c(OH-)为0.3 mol/L(此时溶液的体积为100 mL),试计算:
(1)原混合碱溶液中所含Ba(OH)2的物质的量是________。
(2)原混合溶液中NaOH的物质的量浓度是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色酸性溶液中能大量共存的一组离子是
A.Na+、K+、HCO3-、NO3-B.Mg2+、SO42-、Al3+、NO3-
C.Na+、K+、 NO3-、AlO2-D.K+、MnO4-、CH3COO-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知pC=-lgc;Ksp[Cu(OH)2]=2.2×10-20和Ksp[Mg(OH)2]=1.8×10-11,测得两种金属离子的PC与pH的变化关系如下图所示。下列说法正确的是

A. 加入氨水调节pH可除去MgS04溶液中的CuSO4杂质
B. pH调到Q点则Mg2+和Cu2+都已沉淀完全
C. 在浓度均为1mo/LCuSO4和MgS04的混合溶液中,存在c(Cu2+)+c(Mg2+)>c(S042-)
D. L1代表pC(Cu2+)随pH变化,L2代表pC(Mg2+)随pH变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验报告中记录下列数据,其中正确的是
A. 用 100 mL 量筒量取 12.5 mL 盐酸
B. 称量 NaOH 固体时,将 NaOH 直接放在托盘上的纸上
C. 需用 220 mL, 1 mol·L-1 CuSO4 溶液,配制时需称 62.5g 的 CuSO4·5H2O 晶体
D. 配制稀硫酸时,先向烧杯中注入浓硫酸,再加水稀释
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com