
【题目】下列说法正确的是
A.25℃时NH4Cl溶液的Kw大于100℃时NaCl溶液的Kw
B.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
C.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
D.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
【答案】C
【解析】
Kw是水的离子积常数,Kw的大小只有温度有关;不同催化剂对反应的催化效果不同;加入NH4Cl溶液,平衡正向移动;在含有BaSO4沉淀的溶液中存在沉淀溶解平衡,![]() ,沉淀溶解平衡常数只与温度有关。
,沉淀溶解平衡常数只与温度有关。
A.Kw是水的离子积常数,Kw的大小只有温度有关,25℃时在任何溶液中,Kw均为恒定值,故A错误;
B.不同催化剂对反应的催化效果不同,故反应速率的改变不同,故B错误;
C.加入NH4Cl溶液,发生反应:![]() ,
,![]() 减小,平衡正向移动,促进Mg(OH)2的溶解,故Mg(OH)2可溶于NH4Cl溶液,C正确;
减小,平衡正向移动,促进Mg(OH)2的溶解,故Mg(OH)2可溶于NH4Cl溶液,C正确;
D.在含有BaSO4沉淀的溶液中存在沉淀溶解平衡,![]() ,加入Na2SO4固体,
,加入Na2SO4固体,![]() 增大,
增大,![]() 为定值,故
为定值,故![]() 减小,D错误;
减小,D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1mol/L醋酸溶液中滴加0.1 mol/L的氢氧化钠溶液,测定结果如下图所示。下列解释不正确的是

A. 0.1mol/L醋酸溶液pH约为3,说明醋酸是弱电解质
B. m大于20
C. a点表示的溶液中,c(CH3COO— )>c(Na+)
D. b点表示的溶液中,溶质为醋酸钠和氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学式为C5H7Cl的有机物,其结构不可能是( )
A.只含1个![]() 键的直链有机物
键的直链有机物
B.含2个![]() 键的直链有机物
键的直链有机物
C.含1个![]() 键的环状有机物
键的环状有机物
D.含1个—C![]() C—键的直链有机物
C—键的直链有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计一个燃料电池并探究氯碱工业原理和电解CuSO4溶液,其中乙装置中X为阳离子交换膜。
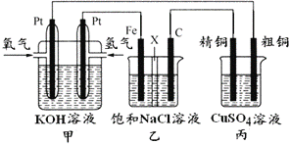
根据要求回答相关问题:
(1)通入氧气的电极为___(填“正极”或“负极”),负极的电极反应式为___。
(2)铁电极为___(填“阳极”或“阴极”),石墨电极(C)的电极反应式为___。
(3)乙装置中电解的总反应的离子方程式为___。
(4)若在标准状况下,有1.12L氧气参加反应,丙装置中阴极增重的质量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A.NH3分子与H+结合的过程中,N原子的杂化类型未发生改变
B.某晶体固态不导电,熔融状态能导电,可以较充分说明该晶体是离子晶体
C.区分晶体和非晶体最可靠的科学方法是对固体进行X-射线衍射实验
D.气态SO3和SO2中心原子的孤电子对数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,AgI饱和溶液中c(Ag+)=1.22×10-8 mol·L-1,AgCl的饱和溶液中c(Ag+)=1.3×10-5 mol·L-1。若在5mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01 mol·L-1的AgNO3溶液。下列叙述中不正确的是
A.若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀
B.溶液中先产生的是AgI沉淀
C.AgCl的Ksp的数值为1.69×10-10
D.反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷、乙烯、苯、乙醇、乙酸和乙酸乙酯是生产和生活中常用的有机物。回答下列有关问题:
(1)CH4和Cl2在光照条件下反应生成CH3Cl、CH2Cl2、CHCl3、CCl4等有机物,这些反应的有机反应类型是___。
(2)CH2=CH2能够使溴水褪色,请写出该反应的化学方程式___,将足量CH2=CH2通入少量酸性高锰酸钾溶液的反应现象是___。
(3)用苯提取碘水中碘单质所采用的分离方法是___。
(4)写出乙酸所含官能团的名称___。
(5)写出乙酸和乙醇在浓硫酸作用下生成乙酸乙酯的化学反应方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,能长时间保持稳定的放电电压。其电池总反应为:3Zn + 2K2FeO4 + 8H2O![]() 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-= Zn(OH)2
B. 充电时阳极发生氧化反应,附近溶液碱性增强
C. 充电时每转移3mol电子,阴极有1.5molZn生成
D. 放电时正极反应为:FeO42- + 3e- + 4H2O = Fe(OH)3 + 5OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组同学对金属镁与![]() 溶液的反应产生了浓厚的兴趣.可供选择的实验试剂为:镁粉,
溶液的反应产生了浓厚的兴趣.可供选择的实验试剂为:镁粉,![]() 溶液,
溶液,![]() 盐酸溶液,
盐酸溶液,![]() 溶液,
溶液,![]() 溶液,
溶液,![]() 溶液
溶液
![]() 研究小组做了如下几组实验,请完成下面表格
研究小组做了如下几组实验,请完成下面表格![]() 表中不要留空格
表中不要留空格![]() :
:
编号 | 镁粉 |
|
|
|
① | 5 | 0 | 20 | 0 |
② | 5 | 0 | 0 | ______ |
③ | ______ | 20 | 0 | 0 |
从实验结果得知,常温下镁几乎不和水反应,却很容易与![]() ,
,![]() 溶液反应产生气体,实验②的目的是验证铵根离子能和镁反应,但同学们认为这个方案还应该补充:______.
溶液反应产生气体,实验②的目的是验证铵根离子能和镁反应,但同学们认为这个方案还应该补充:______.
![]() 研究小组提出如下猜测:
研究小组提出如下猜测:
假设一:![]() 是这个反应的催化剂,能促进水和镁反应:
是这个反应的催化剂,能促进水和镁反应:
假设二:![]() 是镁和水反应的催化剂;
是镁和水反应的催化剂;
假设三:______![]()
请写出![]() 水解反应离子反应方程式:______.
水解反应离子反应方程式:______.
![]() 研究小组发现除了生产氢气外,还生成了能使湿润的红色石蕊试纸测变蓝的气体.请简写出用试纸测试气体的过程______
研究小组发现除了生产氢气外,还生成了能使湿润的红色石蕊试纸测变蓝的气体.请简写出用试纸测试气体的过程______
![]() 为验证假设二,请你设计一个实验方案,写出实验步骤和结论.
为验证假设二,请你设计一个实验方案,写出实验步骤和结论.
实验步骤![]() 不要求写出具体操作过程
不要求写出具体操作过程![]() :______
:______
实验结论 ______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com