
【题目】甲烷、乙烯、苯、乙醇、乙酸和乙酸乙酯是生产和生活中常用的有机物。回答下列有关问题:
(1)CH4和Cl2在光照条件下反应生成CH3Cl、CH2Cl2、CHCl3、CCl4等有机物,这些反应的有机反应类型是___。
(2)CH2=CH2能够使溴水褪色,请写出该反应的化学方程式___,将足量CH2=CH2通入少量酸性高锰酸钾溶液的反应现象是___。
(3)用苯提取碘水中碘单质所采用的分离方法是___。
(4)写出乙酸所含官能团的名称___。
(5)写出乙酸和乙醇在浓硫酸作用下生成乙酸乙酯的化学反应方程式___。
【答案】取代反应 CH2=CH2+Br2→![]() 高锰酸钾溶液褪色 分液 羧基 CH3CH2OH+CH3COOH
高锰酸钾溶液褪色 分液 羧基 CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
【解析】
(1)CH4和Cl2在光照条件下的反应是氯原子代替了甲烷分子中的氢原子;
(2)CH2=CH2与溴水反应生成1,2-二溴乙烷;CH2=CH2能被酸性高锰酸钾氧化;
(3)用苯提取碘水中碘单质,苯难溶于水,液体分层;
(4)乙酸的结构简式是CH3COOH;
(5)乙酸和乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯和水;
(1)CH4和Cl2在光照条件下的反应是氯原子代替了甲烷分子中的氢原子,反应类型是取代反应;
(2)CH2=CH2与溴水反应加成生成1,2-二溴乙烷,反应方程式是CH2=CH2+Br2→![]() ;CH2=CH2能被酸性高锰酸钾氧化,将足量CH2=CH2通入少量酸性高锰酸钾溶液的反应现象是高锰酸钾溶液褪色;
;CH2=CH2能被酸性高锰酸钾氧化,将足量CH2=CH2通入少量酸性高锰酸钾溶液的反应现象是高锰酸钾溶液褪色;
(3)用苯提取碘水中碘单质,苯难溶于水,液体分层,分离方法是分液;
(4)乙酸的结构简式是CH3COOH,官能团的名称是羧基;
(5)乙酸和乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯和水,反应方程式是CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素:

试回答下列问题:(答案中涉及字母均用具体元素符号作答)
(1)I的元素符号为___, 在周期表中位于______区。
(2)写出A原子的核外电子排布的电子排布图 _____________________ ,写出基态时J元素基态原子原子的价电子排布式_______________,J在周期表中的位置是__________;
(3)ABGH的原子半径大小顺序是________________;ABCD的第一电离能大小顺序是_______;ABCD的电负性大小顺序是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K、Ka、Kw、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是___。
![]() 它们都能反映一定条件下对应变化进行的程度
它们都能反映一定条件下对应变化进行的程度
![]() 它们的大小都随温度的升高而增大
它们的大小都随温度的升高而增大
![]() 常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)已知25℃时CH3COOH和NH3·H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为___,溶液中离子浓度大小关系为___。
(3)氯化铝溶液蒸干、灼烧后得到的固体物质是___。
(4)泡沫灭火器的反应原理(硫酸铝溶液与小苏打)___。(写离子方程式)
(5)已知在25℃时Ksp[Mg(OH)2]=3.2×10-11,Ksp[Cu(OH)2]=2.2×10-20。25℃时,向浓度均为0.02mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成沉淀___(填化学式);当两种沉淀共存时,![]() =___。
=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.25℃时NH4Cl溶液的Kw大于100℃时NaCl溶液的Kw
B.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
C.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
D.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图不一致的是
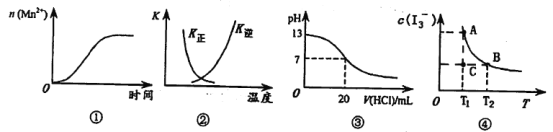
A.图①表示5 mL 0.01 mol·L-1 KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
B.图②中曲线表示反应2SO2(g)+O2(g)![]() 2SO3(g) △H<0正、逆反应的平衡常数K随温度的变化
2SO3(g) △H<0正、逆反应的平衡常数K随温度的变化
C.图③表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
D.I2在KI溶液中存在I2(aq)+I-(aq)![]() I3-(aq)的平衡,c(I3-)与温度T的关系如图④,若反应进行到状态C时,一定有V(正)>V(逆)
I3-(aq)的平衡,c(I3-)与温度T的关系如图④,若反应进行到状态C时,一定有V(正)>V(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,A是氯气发生器,C.D为气体净化装置,其中C中装有饱和食盐水,D中装有浓硫酸,E为装有细铜丝网的硬质玻璃管,F为干燥的广口瓶,烧杯G中装有氢氧化钠溶液。
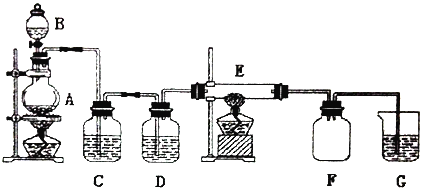
(1)C装置的作用是___,D装置的作用是___。
(2)E装置中发生的化学反应方程式是___。
(3)F装置的作用是___。
(4)G装置中所发生反应的离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:

下列说法正确的是
A.甲池通入O2的电极反应为O2 + 4e-+ 4H+=2H2O
B.乙池 Ag电极增重6.4g,溶液中将转移0.2mol电子
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物只含C、H、O三种元素,取4.6 g该有机化合物完全燃烧,测得只生成0.2mol CO2和5.4 g水,其质谱图和核磁共振氢谱如下图所示,该有机化合物是

A.CH3CHO
B.CH3CH2OH
C.CH3OCH3
D.CH3OCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做浓硫酸与铜反应的实验过程中,观察到铜片表面变黑,于是对黑色物质的组成进行实验探究。
(1)用如右图所示装置进行实验1。(加热和夹持仪器已略去)

实验1:铜片与浓硫酸反应
操作 | 现象 |
加热到120℃~250℃ | 铜片表面变黑,有大量气体产生,形成墨绿色浊液 |
继续加热至338℃ | 铜片上黑色消失,瓶中出现“白雾”,溶液略带蓝色,瓶底部有较多灰白色沉淀 |
①装置B的作用是________;装置C中盛放的试剂是_______。
②为证明A装置中灰白色沉淀的主要成分为硫酸铜,实验操作及现象是___________。
(2)探究实验1中120℃~250℃时所得黑色固体的成分。
【提出猜想】黑色固体中可能含有CuO、CuS、Cu2S中的一种或几种。
【查阅资料】
资料1:亚铁氰化钾[K4Fe(CN)6]是Cu2+的灵敏检测剂,向含有Cu2+的溶液中滴加亚铁氰化钾溶液,生成红棕色沉淀。
资料2:
CuS | Cu2S |
黑色结晶或粉末 | 灰黑色结晶或粉末 |
难溶于稀硫酸;可溶于硝酸;微溶于浓氨水或热的浓盐酸 | 难溶于稀硫酸和浓盐酸;可溶于硝酸;微溶于浓氨水 |
【设计并实施实验】
实验2.探究黑色固体中是否含CuO
操作 | 现象 |
i.取表面附着黑色固体的铜片5片,用清水洗干净,放入盛有10mL试剂A的小烧杯中,搅拌 | 黑色表层脱落,露出光亮的铜片 |
ii.取出铜片,待黑色沉淀沉降 | 上层溶液澄清、无色 |
①试剂A是_________。
②甲认为ii中溶液无色有可能是Cu2+浓度太小,于是补充实验确认了溶液中不含Cu2+,补充的实验操作及现象是______。
实验3.探究黑色固体中是否含CuS、Cu2S
操作 | 现象 |
i.取实验2中黑色固体少许,加入适量浓氨水,振荡后静置 | 有体剩余,固液分界线附近的溶液呈浅蓝色 |
ii.另取实验2中黑色固体少许,加入适量浓盐酸,微热后静置 | 有固体剩余,溶液变成浅绿色 |
【获得结论】由实验2和实验3可得到的结论是:实验1中,120℃~250℃时所得黑色固体中_______。
【实验反思】
分析实验1中338℃时产生现象的原因,同学们认为是较低温度时产生的黑色固体与热的浓硫酸进一步反应造成。已知反应的含硫产物除无水硫酸铜外还有二氧化硫,则黑色固体消失时可能发生的所有反应的化学方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com