
【题目】下列事实不能用勒夏特列原理解释的是
A. 开启啤酒瓶后,瓶中立刻泛起大量泡沫
B. 由H2、I2蒸气、HI组成的平衡混合物加压后颜色变深
C. 向氯水中加适量NaHCO3后,溶液漂白能力增强
D. 在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
【答案】B
【解析】试题分析:A.因溶液中存在二氧化碳的溶解平衡,开启啤酒瓶后,压强减小,二氧化碳逸出,能用勒夏特列原理解释,故A不选;B.该反应反应前后气体体积不变,所以压强不影响化学平衡的移动,增大平衡体系的压强气体的体积减小,碘的浓度增大,颜色变深,所以不能用勒夏特列原理解释,故B选
C.依据氯水中的化学平衡为Cl2+H2O![]() HCl+HClO,加入碳酸氢钠和盐酸反应促进平衡正向进行,次氯酸浓度增大,漂白性增强,和平衡有关,能用勒夏特利原理解释,故C不选;D.溶液中存在平衡Fe3++SCN-
HCl+HClO,加入碳酸氢钠和盐酸反应促进平衡正向进行,次氯酸浓度增大,漂白性增强,和平衡有关,能用勒夏特利原理解释,故C不选;D.溶液中存在平衡Fe3++SCN-![]() Fe(SCN)2+,加铁粉,铁与Fe3+反应,Fe3+浓度降低,则平衡向左移动进行,溶液颜色变浅或褪去,能用勒夏特利原理来解释,故D不选;故选B。
Fe(SCN)2+,加铁粉,铁与Fe3+反应,Fe3+浓度降低,则平衡向左移动进行,溶液颜色变浅或褪去,能用勒夏特利原理来解释,故D不选;故选B。


科目:高中化学 来源: 题型:
【题目】某科学探究小组为探究电化学原理,设计了如下图所示的装置进行探究实验。下列对实验中观察到的现象或有关结论错误的是 ( )

A.a和b不连接时,铁片上有红色的铜析出,该装置不能形成原电池
B.a和b用导线连接时铜片为负极,发生的反应为:Cu2++2e-=Cu
C.无论a和b是否连接,铁片均会被氧化,溶液中均有Fe2+生成
D.a和b用导线连接时,溶液中的Cu2+应向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(g)+xB(g) ![]() 2C(g),2 min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是( )
2C(g),2 min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是( )
A. 平衡时,物质的量之比n(A)∶n(B)∶n(C)=2∶11∶4
B. x值等于3
C. A的转化率为20%
D. B的平均反应速率为0.4 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列一卤代烷,不能发生消去反应的是 ( )
A. CH3CH2ClB. (CH3)2CHClC. (CH3)3CClD. (CH3)3CCH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物的结构简式如图所示.有关该化合物的叙述不正确的是( )

A. 该有机物的分子式为C11H12O2
B. 1mol该物质最多能与4mol H2发生加成反应
C. 该有机物在一定条件下,可以发生取代、氧化、酯化反应
D. 该有机物能与热的新制氢氧化铜悬浊液反应,生成砖红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是( )
A.p(H2)>p(Ne)>p(O2) B.p(O2)>p(Ne)>p(H2)
C.p(H2)>p(O2)>p(Ne) D.p(Ne)>p(H2)>p(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某基态原子的外围电子排布为3d14s2,则下列说法正确的是( )
A. 该元素属于P区B. 该元素原子核外有4个电子层
C. 该元素原子最外层共有3个电子D. 该元素原子M能层共有8个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家提出“绿色自由”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH)。该反应的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
(1)若在一个定温定容的容器中发生上述反应,反应达到平衡的标志是________。
A.CO2和CH3OH的浓度相等
B.H2的百分含量保持不变
C.容器内压强保持不变
D.3v正(H2)=v逆(H2O)
E.容器中混合气体的密度保持不变
(2)若将CO2和H2的混合气体分成五等份,将它们分别充入温度不同、容积相同的恒容容器中发生上述反应。反应相同时间后,测得甲醇的体积分数 (CH3OH)与反应温度T的关系如图,则上述CO2转化为甲醇的反应的△H_____0(填“>”、“<”、“=”)
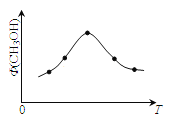
(3)上述反应在实际生产中采用的温度是300℃,其目的是_________________。
(4)300℃时,将CO2与H2按1∶3的体积比充入某密闭容器中,CO2的平衡转化率(a)与体系总压强(P)的关系如图所示。回答问题:
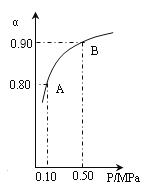
①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再次达到平衡,与原平衡相比较下列说法正确的是_______。
A.CO2的浓度减小 B.正反应速率增大,逆反应速率减小
C.CO2和H2的体积比仍然是1∶3 D.H2的体积分数减小
②B点平衡混合气体的平均摩尔质量为_______________(保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com