
 CH3+;
CH3+; CH3-.
CH3-.分析 (1)磷酸根离子价层电子对个数为4且不含孤电子对,根据价层电子对互斥理论判断磷酸根离子空间构型;
(2)根据分子的空间构型、杂化类型以及价层电子数结合题干信息它们的粒子中均含有1个碳原子和3个氢原子来判断;
(3)由第二周期元素为中心原子,通过sp3杂化形成中性分子,如果该分子为正四面体结构,则该分子的价层电子对个数是4且不含孤电子对,如果是三角锥型分子,则该分子中价层电子对个数是4且含有一个孤电子对,如果是V型分子,则该分子中价层电子对个数是4且具有2个孤电子对;
(4)根据等电子体是指具有相同价电子总数和原子总数的分子或离子来回答;根据价电子对互斥理论确定原子的杂化方式,价层电子对个数=σ键个数+孤电子对个数.
解答 解:(1)磷酸根离子价层电子对个数为4且不含孤电子对,根据价层电子对互斥理论知磷酸根离子空间构型为正四面体结构,
故答案为:正四面体结构;
(2)甲的空间结构为平面三角形,则碳原子为sp2杂化,中心碳原子无孤电子对,因此价层电子对数3,化学式为CH3+,乙的空间结构为三角锥形,则碳原子为sp3杂化,中心碳原子有1个孤电子对,因此价层电子对数4,化学式CH3-,
故答案为:CH3+;CH3-;
(3)由第二周期非金属元素构成的中性分子,第二周期元素为中心原子,通过sp2杂化形成中性分子,是平面形分子,该类型分子有BF3,
第二周期元素为中心原子,通过sp3杂化形成中性分子,如果是三角锥型分子,则该分子中价层电子对个数是4且含有一个孤电子对,该类型分子有NF3,
如果该分子为正四面体结构,则该分子的价层电子对个数是4且不含孤电子对,该类型分子有CF4,
故答案为:BF3;NF3;CF4.
(4)SO3的原子数为4,价电子数为24,与SO3互为等电子体的为NO3-或CO32-、BF3或COCl2等,NO3-中N原子形成3个σ键,没有孤电子对,杂化类型为sp2,碳酸根离子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(4+2-3×2)=3,所以原子杂化方式是sp2,SO3分子中S原子电子对数为$\frac{6+0}{2}$,杂化类型为sp2,
故答案为:NO3-;CO32-;sp2.
点评 本题考查较为综合,涉及电子排布式、分子的极性、杂化类型等知识,题目难度中等,注意杂化类型与空间构型的关系的判断,注意孤电子对个数的计算方法,为易错点..


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:选择题
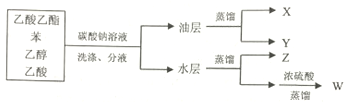
| A. | X是最简单的芳香烃,分子中含有三个碳碳双键 | |
| B. | Y是具有芳香气味的液体,难溶于水,易溶于有机溶剂,能发生水解反应 | |
| C. | Z是无色,有特殊香味的液体,与硫酸混合在140℃可以制备乙烯 | |
| D. | W是有强烈刺激性气味的无色液体,可与氢气发生加成反应,生成Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
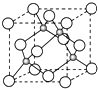 A、B、C是短周期非金属元素,核电荷数依次增大.A元素原子核外有三种不同的能级且各个能级所填充的电子数相同,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C是短周期非金属元素,核电荷数依次增大.A元素原子核外有三种不同的能级且各个能级所填充的电子数相同,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③⑥ | C. | ①②④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点由高到低:NaCl>Na-K合金>Na | |
| B. | 晶体的熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| C. | 晶体的硬度由大到小:金刚石>碳化硅>晶体硅 | |
| D. | 晶体的晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
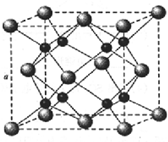 A、B、C、D为原子序数依次增大的四种元素,A原子基态时原子轨道上有两个未成对电子,A2-和B+具有相同的电子层结构;C、D为同周期元素,C元素基态原子核外电子总数是其最外层电子数的3倍;D元素基态原子的最包层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A原子基态时原子轨道上有两个未成对电子,A2-和B+具有相同的电子层结构;C、D为同周期元素,C元素基态原子核外电子总数是其最外层电子数的3倍;D元素基态原子的最包层有一个未成对电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
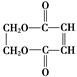 )可用于生产合成树脂、合成橡胶等.以丙烯为原料制备环酯J的合成路线如图:
)可用于生产合成树脂、合成橡胶等.以丙烯为原料制备环酯J的合成路线如图: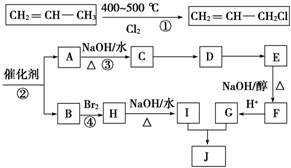
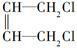 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$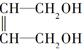 +2NaCl.
+2NaCl. ,G分子中含有的官能团是羧基和碳碳双键(填官能团名称).
,G分子中含有的官能团是羧基和碳碳双键(填官能团名称).查看答案和解析>>
科目:高中化学 来源: 题型:多选题


| A. | 反应①、③的原子利用率均为100% | |
| B. | 两种流程最终分离HCOOH都用洗涤液分液法 | |
| C. | 从原料充分利用角度看,流程二比流程一更优 | |
| D. | 两种流程总反应均为CO+H2O→HCOOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com