
【题目】铁、钴(Co)、镍(Ni)是同族元素,它们的化合物在工业上有重要的应用。
(1)现将含0.5mol FeCl3的溶液和含0.5mol KSCN的溶液混合,混合后溶液体积为1L,已知溶液存在平衡:Fe3+(aq)+SCN-(aq) ![]() Fe(SCN)2+(aq)(忽略其它过程)。
Fe(SCN)2+(aq)(忽略其它过程)。
平衡浓度c[Fe(SCN)2+]与温度T的关系如图所示:
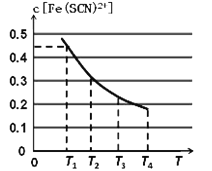
则该反应△H____0(填“>”或“<”),温度为T1时,反应在5秒钟时达到平衡,平c[Fe(SCN)2+]=0.45 mol/L,求达到平衡时的平均反应速率v(SCN-)=____mol·L-1·S-1,该温度下的Fe3+的平衡转化率为_____,该温度下反应的平衡常数为__________。
(2)草酸钴(CoC2O4)是一种难溶于水的浅粉红色粉末,通常用硫酸钴溶液和草酸铵溶液反应制得,写出该反应的离子方程式:______________________。
(3)已知某溶液中,Co2+、Ni2+的浓度分别为0.60mol/L和1.2mol/L,取一定量的该溶液,向其中滴加NaOH溶液,已知Ksp[Co(OH)2]=6.0×10﹣15,Ksp[Ni(OH)2]=2.0×10﹣15,当Co(OH)2开始沉淀时,溶液中![]() 的值等于______。(取两位有效数字)
的值等于______。(取两位有效数字)
(4)CoxNi(1-x)Fe2O4 (其中Co、Ni均为+2价)可用作H2O2分解的催化剂,具有较高的活性。两种不同方法制得的催化剂在10℃时催化、分解6%的H2O2溶液的相对初始速率随x变化的曲线如图所示。
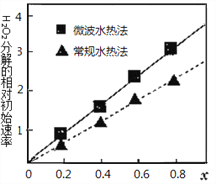
由图中信息可知:__________法制取得到的催化剂活性更高;Co2+、Ni2+ 两种离子中催化效果较好的是_____________________。
【答案】 < 0.09 90% 180 CO2— + Co2+ = CoCO↓ 3.0 微波水热 Co2+
【解析】(1)根据图像可知升高温度c[Fe(SCN)2+]减小,这说明升高温度平衡向逆反应方向进行,所以正反应是放热反应,则该反应△H<0;温度为T1时,反应在5秒钟时达到平衡,平衡时c[Fe(SCN)2+]=0.45 mol/L,则消耗SCN-的浓度是0.45mol/L,因此达到平衡时的平均反应速率v(SCN-)=0.45mol/L÷5s=0.09mol·L-1·S-1,消耗铁离子是0.45mol,所以该温度下的Fe3+的平衡转化率为![]() ×100%=90%。平衡时Fe3+(aq)、SCN-(aq)的浓度分别是0.05mol/L,所以该温度下反应的平衡常数为
×100%=90%。平衡时Fe3+(aq)、SCN-(aq)的浓度分别是0.05mol/L,所以该温度下反应的平衡常数为![]() =180。(2)硫酸钴溶液和草酸铵溶液发生复分解反应生成难溶的草酸钴,反应的离子方程式为CO2— + Co2+ = CoCO↓;(3)当Co2+开始沉淀时,溶液中存在两个溶解平衡:CO(OH)2CO2++2OH-,Ni(OH)2Ni2++2OH-,溶液中c(Co2+)/c(Ni2+)=c2(OH-)c(Co2+)/c2(OH-)c(Ni2+)=Ksp[Co(OH)2]/Ksp[Ni(OH)2]=3.0;(4)过氧化氢的分解速率越大,催化剂活性更高,根据图象可知,x相同时,微波水热法初始速度大于常规水热法,故微波水热法制得催化剂的活性更高;由图可知,随x值越大,过氧化氢的分解速率越大,而x增大,Co2+的比例增大,故Co2+的催化活性更高。
=180。(2)硫酸钴溶液和草酸铵溶液发生复分解反应生成难溶的草酸钴,反应的离子方程式为CO2— + Co2+ = CoCO↓;(3)当Co2+开始沉淀时,溶液中存在两个溶解平衡:CO(OH)2CO2++2OH-,Ni(OH)2Ni2++2OH-,溶液中c(Co2+)/c(Ni2+)=c2(OH-)c(Co2+)/c2(OH-)c(Ni2+)=Ksp[Co(OH)2]/Ksp[Ni(OH)2]=3.0;(4)过氧化氢的分解速率越大,催化剂活性更高,根据图象可知,x相同时,微波水热法初始速度大于常规水热法,故微波水热法制得催化剂的活性更高;由图可知,随x值越大,过氧化氢的分解速率越大,而x增大,Co2+的比例增大,故Co2+的催化活性更高。


 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D中,表示该反应速率最快的是( )
3C+4D中,表示该反应速率最快的是( )
A.v(A) = 0.7mol·L-1·S-1 B.v(B) = 0.3 mol·L-1·S-1
C.v(C) = 0.8mol·L-1·S-1 D.v(D) = 1 mol·L-1·S-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组化合物中,化学键类型完全相同的是( )
A. CaH2 和 Na2S B. Na2O 和Na2O2
C. CO2 和CaO D. HCl 和NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。下列关于该电池叙述错误的是( )
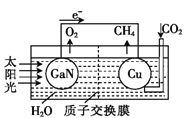
A.电池工作时,是将太阳能转化为电能
B. 铜电极为正极,电极反应式为:CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.为提高该人工光合系统的工作效率,可向装置中加入少量硝酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是
A. 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2NA
B. 将1 mol Cl2通入水中,HC1O、Cl-、ClO-粒子数之和为2NA
C. 标准状况下,44.8L NO与22.4 L O2反应后的分子数是2NA
D. 27g铝中加入1mol/L的NaOH溶液,转移电子数是3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙酸(HA)的酸性比甲酸(HB)弱,常温下0.1mol/L HA和0.1mol/L HB的pH均大于2。在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是( )
A. c(OH-)>c(HA)>c(HB)>c(H+) B. c(OH-)>c(A-)>c(B-)>c(H+)
C. c(OH-)>c(B-)>c(A-)>c(H+) D. c(OH-)>c(HB)>c(HA)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2016·海南卷)利用太阳能分解水制氢,若光解0.02 mol水,下列说法正确的是
A.可生成H2的质量为0.02 g
B.可生成氢的原子数为2.408×1023个
C.可生成H2的体积为0.224 L(标准情况)
D.生成H2的量理论上等于0.04 mol Na与水反应产生H2的量(注:2Na+2H2O![]() 2NaOH+H2↑)
2NaOH+H2↑)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为ρg/ml,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是 ( )
A. ρ=(17V+22400)/(22.4+22.4V) B. ω=17c/(1000ρ)
C. ω =17V/(17V+22400) D. c=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制一定物质的量浓度的溶液,一定要用到的一组仪器是( )
A. 托盘天平、药匙、烧杯、容量瓶
B. 量筒(或滴定管、移液管)、容量瓶
C. 容量瓶、烧杯、玻璃棒、胶头滴管
D. 容量瓶、烧杯、玻璃棒、分液漏斗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com