
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为ρg/ml,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是 ( )
A. ρ=(17V+22400)/(22.4+22.4V) B. ω=17c/(1000ρ)
C. ω =17V/(17V+22400) D. c=1000Vρ/(17V+22400)
科目:高中化学 来源: 题型:
【题目】下列有机物的鉴别方法(必要时可以加热),不能达到目的的是( )
A. 用银氨溶液鉴别葡萄糖、甲酸、乙酸和乙醇溶液
B. 用碘水鉴别淀粉和纤维素
C. 用浓硝酸鉴别蚕丝和人造丝
D. 用氢氧化钠溶液鉴别植物油、汽油和甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴(Co)、镍(Ni)是同族元素,它们的化合物在工业上有重要的应用。
(1)现将含0.5mol FeCl3的溶液和含0.5mol KSCN的溶液混合,混合后溶液体积为1L,已知溶液存在平衡:Fe3+(aq)+SCN-(aq) ![]() Fe(SCN)2+(aq)(忽略其它过程)。
Fe(SCN)2+(aq)(忽略其它过程)。
平衡浓度c[Fe(SCN)2+]与温度T的关系如图所示:
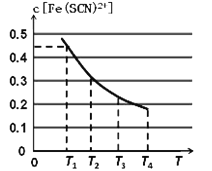
则该反应△H____0(填“>”或“<”),温度为T1时,反应在5秒钟时达到平衡,平c[Fe(SCN)2+]=0.45 mol/L,求达到平衡时的平均反应速率v(SCN-)=____mol·L-1·S-1,该温度下的Fe3+的平衡转化率为_____,该温度下反应的平衡常数为__________。
(2)草酸钴(CoC2O4)是一种难溶于水的浅粉红色粉末,通常用硫酸钴溶液和草酸铵溶液反应制得,写出该反应的离子方程式:______________________。
(3)已知某溶液中,Co2+、Ni2+的浓度分别为0.60mol/L和1.2mol/L,取一定量的该溶液,向其中滴加NaOH溶液,已知Ksp[Co(OH)2]=6.0×10﹣15,Ksp[Ni(OH)2]=2.0×10﹣15,当Co(OH)2开始沉淀时,溶液中![]() 的值等于______。(取两位有效数字)
的值等于______。(取两位有效数字)
(4)CoxNi(1-x)Fe2O4 (其中Co、Ni均为+2价)可用作H2O2分解的催化剂,具有较高的活性。两种不同方法制得的催化剂在10℃时催化、分解6%的H2O2溶液的相对初始速率随x变化的曲线如图所示。
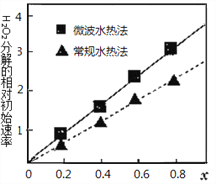
由图中信息可知:__________法制取得到的催化剂活性更高;Co2+、Ni2+ 两种离子中催化效果较好的是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
【实验目的】制取乙酸乙酯
【实验原理】甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。
【装置设计】甲、乙、丙三位同学分别设计了下列三套实验装置:
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,较合理的是________(选填“甲”或“乙”)。丙同学将甲装置进行了改进,将其中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是_______。
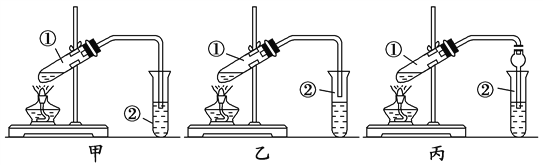
【实验步骤】
(1)用酒精灯对试管①加热;(2)将试管①固定在铁架台上(3)按所选择的装置组装仪器,在试管①中先加入3 mL乙醇,并在摇动下缓缓加入2 mL浓硫酸充分摇匀,冷却后再加入2 mL冰醋酸;(4)在试管②中加入适量的饱和Na2CO3溶液;(5)当观察到试管②中有明显现象时停止实验。
【问题讨论】
a.用序号写出该实验的步骤____________;
b.装好实验装置,加入药品前还应检查____________;
c.写出试管①发生反应的化学方程式(注明反应条件) _____________________;
d.试管②中饱和Na2CO3溶液的作用是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素在周期表中的位置取决于该元素原子的
A. 相对原子质量和核外电子数 B. 相对原子质量和最外层电子数
C. 电了层数和最外层电子数 D. 电子层数和次外层电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于微粒半径大小的下列叙述中不正确的是
A. 同一元素的不同粒子,核外电子数越多,半径越大
B. 同一元素形成的多种价态的离子,价态越低,半径越小
C. 同一元素的原子半径小于相应的阴离子半径
D. 同一元素的原子半径大于相应的阳离子半径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法正确的是( )
A. 大量使用薪柴为燃料,践行低碳生活
B. “雾霾天气”、“温室效应”、“光化学烟雾”的形成均与氮的氧化物无关
C. 工业上常用SO2来漂白纸浆、毛、丝等,此外SO2还可以用于杀菌、消毒
D. CO2或SO2的排放是形成酸雨的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某绿色农药结构简式为 ,回答下列问题。
,回答下列问题。
(1)N元素的基态原子核外有_____种空间运动状态的电子,该农药组成元素中,第一电离能较大的前三种元素是(按由大到小顺序排列)________(用元素符号回答,下同),基态硒原子的价层电子排布式为___________。
(2)该物质中,中心原子杂化轨道类型为sp2的原子有_____,分子中编号为① 的碳原子和与其成键的另外几个原子构成的空间结构为_________。
(3)碳、氢、氧元素可形成一系列的化合物,如CH4、C2H6、CH3OH等。三种物质的沸点高低顺序为CH42H63OH,其原因是________,三种物质中属于极性分子的物质是______, 与CH4互为等电子体的一种微粒是_________。
(4)硒化锌的晶胞结构如图所示,则硒的配位数为________,若晶胞边长为d pm ,设阿伏加德罗常数的值为NA,则硒化锌的密度为______(不必化简)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com