
(12分)(1)环境专家认为可以用金属铝将水体中的NO3 - 转化为N2,从而消除污染。该反应中涉及的微粒有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将这些微粒中除NO3-以外的微粒填入以下空格内(不用配平)。

该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应是4Al +3O2 +6H2O =4 Al(OH)3 。电池正极的电极反应式是 ;消耗13.5 g Al时转移_________mole-。
(3)铝与某些金属氧化物在高温下的反应称为铝热反应,可用于冶炼高熔点的金属。
已知:4Al(s) +3O2(g) = 2Al2O3(s) △H = -2830 kJ/mol
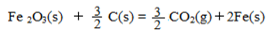 △H = +230 kJ/mol
△H = +230 kJ/mol
C(s)+O2(g) = CO2(g) △H = -390 kJ/mol
铝与氧化铁发生铝热反应的热化学方程式是 ,铝热反应属于______(填字母)反应。
a.氧化还原 b.复分解 c.置换
(1)NO3- + Al +H2O→ Al(OH)3 + N2 + OH-(2分) 5∶3
(2)O2+4e-+2H2O=4OH- 1.5
(3)2 Al(s) + Fe2O3 (s)= 2 Fe(s) +Al2O3 (s) △H = - 600 kJ/mol a c
【解析】
试题分析:(1)根据金属铝将水体中的NO3-转化为N2,可知Al为还原剂,则Al(OH)3为氧化产物,再根据电荷守恒和原子守恒可得:NO3- + Al +H2O→ Al(OH)3 + N2 + OH-;Al元素被氧化,N元素被还原,则被氧化与被还原的元素的物质的量分别为x、y,由电子守恒可知,x×(3-0)=y×(5-0),解得x:y=5:3,所以被氧化与被还原的元素的物质的量之比为5∶3。
(2)由电池总反应4Al+3O2+6H2O=4Al(OH)3可知,Al作负极,氧气在正极上得电子发生还原反应,正极反应为2H2O+O2+4e-=4OH-;Al元素由0价升高为+3价,则 Al~3e‾,所以消耗13.5 g Al时转移电子:13.5g÷27g/mol×3=1.5mol。
(3)首先写出化学方程式并注明各物质的状态,然后根据盖斯定律求出∆H,∆H=1/2 ∆H1+∆H2 – 3/2 ∆H3=- 600 kJ•mol‾1,可写成热化学方程式;铝热反应发生了化合价的变化,为氧化还原反应,反应物为一种单质和一种化合物,生成了一种新的单质和一种新的化合物,也属于置换反应,故a、c选项正确。
考点:本题考查离子方程式、电极方程式、热化学方程式的书写和相关计算。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
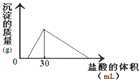 (1)环境专家认为可以用铝将水中的NO3- 转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将各粒子分别填入以下空格(请将整个方程式配平后写在答题纸上).
(1)环境专家认为可以用铝将水中的NO3- 转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将各粒子分别填入以下空格(请将整个方程式配平后写在答题纸上).| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)环境专家认为可以用金属铝将水体中的NO![]() 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH![]() 、Al(OH)3、NO
、Al(OH)3、NO![]() 、N2,请将各粒子分别填入以下空格内(不用配平)。
、N2,请将各粒子分别填入以下空格内(不用配平)。
该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=
4Al(OH)3。电池正极的电极反应式为 ;正极材料采用了铂网,利用铂网为正极的优点是 。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
Fe2O3(s)+![]() C(s)=
C(s)= ![]() CO2(g)+2Fe(s) △H=234.1kJ/mol
CO2(g)+2Fe(s) △H=234.1kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
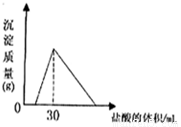
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:
则反应过程中产生氢气的总体积为 L(标准状况)。
查看答案和解析>>
科目:高中化学 来源:2010届南京一中高三考前冲刺化学卷 题型:填空题
(1)环境专家认为可以用金属铝将水体中的NO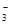 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH 、Al(OH)3、NO
、Al(OH)3、NO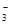 、N2,请将各粒子分别填入以下空格内。
、N2,请将各粒子分别填入以下空格内。
NO3—+ + + +
该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=
4Al(OH)3。正极材料采用了铂网,利用铂网为正极的优点是 。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
Fe2O3(s)+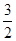 C(s)=
C(s)=
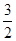 CO2(g)+2Fe(s)
△H=+234.1kJ/mol
CO2(g)+2Fe(s)
△H=+234.1kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
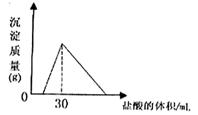
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如右图,则合金的质量为 克。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com