
�о�����ȿ���CO��CO2��Ӧ�öԹ�����̬������������Ҫ�����塣
��1��CO��������������֪��Fe2O3(s) + 3C(s)��2Fe(s) + 3CO(g) ��H 1��+489.0 kJ�� mol��1��C(s) +CO2(g)��2CO(g) ��H 2 ��+172.5 kJ��mol��1�� ��CO��ԭFe2O3(s)���Ȼ�ѧ����ʽΪ �� ��
 ��2��CO��O2��Ƴ�ȼ�ϵ�أ���KOH��ҺΪ���Һ�����õ�صĸ�����ӦʽΪ �� ��
��2��CO��O2��Ƴ�ȼ�ϵ�أ���KOH��ҺΪ���Һ�����õ�صĸ�����ӦʽΪ �� ��
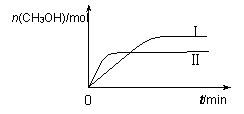
��3��CO2��H2����һ������ĺ����ܱ������У��������¶��·�����Ӧ��CO2(g) +3H2(g) CH3OH(g) +H2O(g) ���CH3OH�����ʵ�����ʱ��ı仯��ͼ5��
CH3OH(g) +H2O(g) ���CH3OH�����ʵ�����ʱ��ı仯��ͼ5��
|
��һ���¶��£����ݻ���ͬ�ҹ̶��������ܱ������У������·�ʽ���뷴Ӧ�һ��ʱ���ﵽƽ�⡣
| �� �� | �� | �� |
| ��Ӧ��Ͷ���� | 1molCO2��3molH2 | a molCO2��3a molH2�� b molCH3OH(g)��b molH2O(g) |
������ƽ��������ѹǿΪ��ʼ��0.8����Ҫʹƽ������������ͬ��ֵ����������ȣ�����ʼʱά�ֻ�ѧ��Ӧ���淴Ӧ������У���b��ȡֵ��ΧΪ �� ��
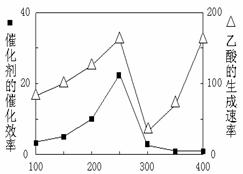 ��4�����ù��ܺ�������ɽ�CO2��H2O(g)ת��ΪCH4��O2�����������ʱ���ڲ�ͬ������I��II��III�������£�CH4���������ʱ��ı仯��ͼ6����0��15Сʱ�ڣ�CH4��ƽ����������I��II��III��С�����˳��Ϊ �� ������ţ���
��4�����ù��ܺ�������ɽ�CO2��H2O(g)ת��ΪCH4��O2�����������ʱ���ڲ�ͬ������I��II��III�������£�CH4���������ʱ��ı仯��ͼ6����0��15Сʱ�ڣ�CH4��ƽ����������I��II��III��С�����˳��Ϊ �� ������ţ���
|
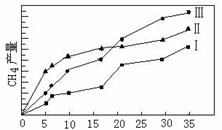
��5����TiO2��Cu2Al2O4Ϊ���������Խ�CO2��CH4ֱ��ת�������ᡣ�ڲ�ͬ�¶��´����Ĵ�Ч����������������ʵĹ�ϵ��ͼ7��
�ٵ��¶��� �� ��Χʱ���¶��������������ʵ���ҪӰ�����ء�
��Cu2Al2O4������ϡ���ᣬϡ���ỹԭ����ΪNO��д���йص����ӷ���ʽ �� ��
��֪ʶ�㡿��ѧƽ��ļ��㣻�Ȼ�ѧ����ʽ����ѧ��Դ���͵��
���𰸽�������1��Fe2O3(s)+ 3CO(g)��2Fe(s)+ 3CO2(g) ��H ����28.5 kJ��mol��1
��2��CO + 4OH���D 2e���� CO32��+ 2H2O
��3������ �� ��0.4��c��1
��4��I��III��II
��5����300�桫400��
��3Cu2Al2O4+32H++2NO3���� 6Cu2++ 6Al3++2NO��+16 H2O
��������1��a��Fe2O3��s��+3C��ʯī��=2Fe��s��+3CO��g����H1=+489.0kJ•mol-1
b��C��ʯī��+CO2��g��=2CO��g����H2=+172.5kJ•mol-1
���ݸ�˹����a-b��3�õ�Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-28.5 kJ•mol-1��
��2��һ����̼�ڸ���ʧ���ӷ���������Ӧ�����ɶ�����̼����Һ������̼��أ�ԭ��ظ����缫��ӦΪ��CO+4OH--2e-=CO32-+2H2O��
��3���ٸ���ͼ���֪���ߢ�ķ�Ӧ���ʴ����ߢ������ߢ��Ӧ���¶ȸ����ߢ��ߢ��Ӧ�ļ״������ʵ���С��Ҳ����˵�¶ȸ߷�Ӧƽ�������ƶ����ݴ��жϷ�Ӧ�ġ�H��0�������¶ȶ�ƽ���ƶ���Ӱ���֪�������¶ȣ�ƽ�������ȷ����ƶ������÷�ӦΪ���ȷ�Ӧ�����������¶�ƽ�������ƶ���ƽ�ⳣ����С����K��K��
����ƽ��ʱ������̼ת����xmol��
�������������������� CO2��g��+3H2��g��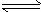 CH3OH��g��+H2O��g����
CH3OH��g��+H2O��g����
��ʼ1��mol���� 1 ���� 3 ���������� 0 ���� 0
�仯1��mol���� x 3x x x
ƽ��1��mol���� 1-x 3-3x x x
��ʼ2������������������a 3a b b
���������֪����x+x+1-x+3-3x��/��1+3��=0.8�����x=0.4��
���ݺ��º��������µĵ�Чƽ���˼�����п�ʼ1�Ϳ�ʼ2Ϊ��ȫ��Ч����a+b=1��Ҫʹ��Ӧʼ����������У���b��x����a�ķ�ΧΪ��0.4��b��1��
��4����ͼ2��֪����0��15Сʱ�ڣ���������ʵ����仯��Ϊ��n������n������n��������0��30h�ڣ�CH4��ƽ����������v����v����v����
��5���ٸ���ͼ��3��֪�����¶ȴ���300��ʱ���ߵ�б�ʱ仯�ϴ�Ҳ�����¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ��ϴʴ�Ϊ��300�桫400�棻
��Cu2Al2O4������������ʽ��Cu2O•Al2O3�����ᷴӦ�������ӷ���ʽ��3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO��+16H2O��
��˼·�㲦��������Ҫ�������Ȼ�ѧ����ʽ����д���缫��Ӧ����д����ѧƽ��ļ��㼰������ԭ��Ӧ����ʽ����д���ۺ��Խ�ǿ����һ�����Ѷȣ�


 ��У������Ԫͬ��ѵ��������ϵ�д�
��У������Ԫͬ��ѵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и�������һ���ܴ����������
A������ɫ��Һ�У�NH4+��Fe2+��SO42-��CO32-
B���ں�����Ba2+����Һ�У�NH4+��Na+��Cl-��OH-
C����ǿ����Һ�У�Na+��K+��Cl-��SO32-
D����pH =1����Һ�У�K+��Fe2+��Cl-��CH3COO-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ��ʾ���ǽ���X��Y�����ǵĺϽ�Z�ֱ����������ᷴӦ�ų�H2����������������ʾ���Ľ��������ʵ������������ʾ�ڱ�״���²���H2������������йغϽ���ɵ��ж���ȷ���ǣ� ��

A��n (Na)��n (Fe)=2��1 B��n (Mg)��n (K)=1��2
C��n (Na)��n (A1)=1��3 D��n (K)��n (A1)=1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ӷ���ʽ��ȷ����
A��HCO3��ˮ������ӷ���ʽ��HCO3����H2O CO32����H3O��
CO32����H3O��
B����ͭΪ�缫��ⱥ��ʳ��ˮ��2Cl��+2H2O Cl2��+H2��+2OH��
Cl2��+H2��+2OH��
C���ð״׳����⣺Fe2O3+6H+ === 3H2O + 2Fe3+
D����FeCl3��Һ�м���Mg(OH)2��3Mg(OH)2+2Fe3+=== 2Fe(OH)3+3Mg2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʱ����20 mL 0.1 mol��L��1�Ĵ�����Һ�в��ϵ���0.1 mol��L��1��NaOH��Һ����Һ��pH�仯���ߣ���ͼ����ʾ���ڵζ������У�������Һ������Ũ�ȴ�С��ϵ����������ȷ����
A��a��ʱ��c( CH3COOH)��c( Na+)��c( CH3COO��)>c( H+)��c( OH ��)
B��b��ʱ��c( Na+) =c( CH3COO��)>c(H+)=c( OH��)
C��c��ʱ��c(OH��)=c(CH3COOH) +c(H+)
D��d��ʱ��c(Na+)>c(CH3COO��)>c(OH��)>c(H+)
 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
С��ϲ����ʵ�飬һ������һ��û�в��ɵ�С�����ڻ��Ͽ���һ�£����ֱ�����������ֽ�һ�Ѹ���Ĺ���С�����ڻ��Ͽ���һ�£�����Ҳ��ͬ����������������������Ϊ�����ǻĹ�����С������������ij��������ɵġ�����Ϊ���������п����ǣ� ��
A��Fe3O4 B��Fe(OH)3 C��Fe2O3 D��Fe(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ���и��������У����ܰ� ����������ʾһ����ɣ���ϵ�ת�����ǣ� ��
���и��������У����ܰ� ����������ʾһ����ɣ���ϵ�ת�����ǣ� ��
| ѡ�� | A | B | C | D |
| a | Fe | CO2 | Al(OH)3 | AlCl3 |
| b | FeCl3 | Na2CO3 | NaAlO2 | Al(OH)3 |
| c | FeCl2 | NaHCO3 | Al2O3 | NaAlO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ӧ A+B ��C����H ��0������������ �� A+B��X ����H ��0�� �� X��C����H ��0������ʾ��ͼ�У�����ȷ��ʾ�ܷ�Ӧ�����������仯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��0���1.01��105 Pa�����£���0.1 g H2��3.2 g SO2��2.2 g CO2��ϣ��û�����������
A��2.24 L������������B��3.36 L
C��4.48 L D��6.72 L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com