
【题目】右图是应用电化学方法检测空气中SO2的原理示意图。下列有关说法不正确的是

A. 该装置工作时能将化学能转变为电能,并有H2SO4生成
B. 电极b表面O2发生还原反应,电极附近溶液的pH升高
C. 电极a表面的电极反应式为:SO2+2H2O-2e-===SO![]() +4H+
+4H+
D. 气体样品应从电极a区域通入,样品中的SO2在电极a表面得到电子
科目:高中化学 来源: 题型:
【题目】给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
A. 粗硅![]() SiCl4
SiCl4![]() Si
Si
B. Mg(OH)2![]() MgCl2(aq)
MgCl2(aq)![]() Mg
Mg
C. Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
D. AgNO3(aq)![]() [Ag(NH3)2]OH(aq)
[Ag(NH3)2]OH(aq)![]() Ag
Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据①﹣⑩在周期表中的位置,用元素符号或化学式回答下列问题:
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ④ | ⑦ | ⑧ | ⑩ | ||||
3 | ② | ③ | ⑤ | ⑥ | ⑨ |
(1)表中元素,化学性质最不活泼的是 , 只有负价而无正价的是 , 还原性最强的单质是 , 可用于制半导体材料的元素是;
(2)最高价氧化物的水化物酸性最强的是 , 呈两性的是 , 最高价氧化物的水化物碱性最强的是 , 电子式为;
(3)在②、③、④、⑤、⑥、⑦、⑧、⑨中,原子半径最大的是;
(4)比较⑥⑦⑨氢化物的稳定性最弱的是;
(5)③元素单质和②元素最高价氧化物对应的水化物相互反应的离子方程式为;
(6)铍(Be)位于元素周期表中第二周期第ⅡA族.相同条件下,单质铍与酸反应比单质锂与酸反应更加(填“剧烈”或“缓慢”),写出铍与盐酸反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如右图所示的装置进行化学反应X+2Y→2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到试管中甲处液面下降,乙处液面上升.关于该反应的下列叙述正确的是( )
①该反应为放热反应
②反应物的总能量比生成物的总能量高
③该反应过程可以看成是“贮存”于X,Y内部的能量转化为热量而释放出来.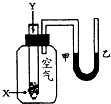
A.①②③
B.①③
C.②③
D.③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】均含有短周期元素W的X,Y,Z三种物质间的转化关系如图所示,下列说法不正确的是( ) 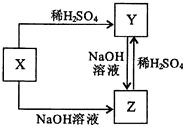
A.W可能是非金属元素
B.X可能是氧化物
C.Y,Z之间的转化可能是氧化还原反应
D.Y和Z在溶液中反应可能生成X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。工业上往往采取下列循环工艺防止铬的污染:
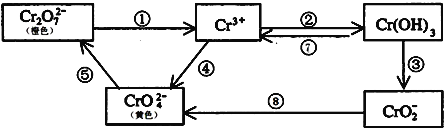
完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下,配平该离子反应方程式:
_____Cr2O72-+Fe3O4+H+→Cr3++Fe3++H2O
(2)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应:阳极_____________________ 阴极_______________________;用铁做阳极的目的是:_____________________
(3)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:______________________
(4)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是__________
(5)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,准确称取纯净的K2Cr2O7 0.294g ,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为_____________________(保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①乙醇、②水、③乙酸、④碳酸、⑤苯酚中羟基上的氢原子的活泼性按由强到弱的顺序排列的是( )
A.③④⑤②①B.③⑤④②①C.④③②⑤①D.④③②①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制取某些气体的装置. 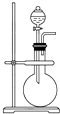
(1)该制气装置在加入反应物前,应事先进行的操作是 .
(2)若用该装置制取O2 , 反应物可选择(填试剂名称);
(3)若用该装置制取NO2 , 反应的化学方程式为 .
(4)利用该装置还可制取(选填下列字母序号)等气体.
a.H2 b.CO2 c.NH3 d.SO2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.
(1)Ⅰ、将钠、钾、镁、铝各1mol分别投入到足量的0.1molL﹣1的盐酸中,写出与盐酸反应最慢的金属发生反应的离子方程式 .
(2)将NaOH溶液与NH4Cl溶液混合生成NH3H2O,从而验证NaOH的碱性大于NH3H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由: .
(3)Ⅱ、利用如图装置可以验证非金属性的变化规律. 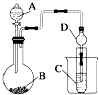
实验室中提供药品浓硫酸、浓盐酸、Na2S、Na2SO3、MnO2、CaCO3,若要证明非金属性Cl>S;装置A、B、C中所装药品分别为 , 装置C中的实验现象为有淡黄色沉淀生成,离子方程式为 .
(4)若要证明非金属性:S>C>Si,则A中加 , B中加Na2CO3 , C中加 , 则观察装置C中的实验现象为有白色沉淀生成.离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com