
【题目】下列离子方程式书写正确的是( )
A.铁粉放入稀硫酸溶液:2Fe+6H+═2Fe3++3H2↑
B.往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH﹣![]() NH3↑+H2O
NH3↑+H2O
C.石灰石与稀盐酸反应:CO32﹣+2H+═ CO2↑+H2O
D.Cl2通入水中:Cl2+H2O = H++Cl﹣+HClO
【答案】D
【解析】
根据题中离子方程式可知,本题考查离子方程式的书写,运用离子方程式的书写步骤分析。
A.铁粉放入稀硫酸溶液生成硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故A错误;
B.往NH4HCO3溶液中加过量的NaOH溶液并加热,碳酸氢根离子也参加反应,正确的离子方程式为:HCO3+NH4++2OH=NH3↑+2H2O+CO32,故B错误;
C.碳酸钙不能拆开,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故C错误;
D. Cl2通入水中生成HCl和HClO,反应的离子方程式为:Cl2+H2OH++Cl+HClO,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售盐酸的总酸量(g/100mL)。
Ⅰ.实验步骤:
(1)用酸式滴定管取待测盐酸溶液20.00mL于锥形瓶中,向其中滴加2滴___作指示剂。
(2)读取盛装0.1000mol/LNaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为____mL。
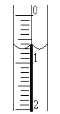
(3)滴定。当___时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(4)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4mL = 15.24mL。
指出他的计算的不合理之处:___。按正确数据处理,可得c(待测盐酸)=___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,向2.0L恒容密闭容器中充入0.80molA,发生反应:![]()
![]() ,经一段时间后达到平衡。反应过程中测定的部分数据见表:
,经一段时间后达到平衡。反应过程中测定的部分数据见表:
时间/min | 0 | 10 | 20 | 30 | 40 |
| 0.80 | 0.60 | 0.48 |
|
|
| 0.00 | 0.20 |
| 0.40 | 0.40 |
下列说法不正确的是
A.该反应在30min时已达到平衡
B.反应在前20min的平均速率为![]()
C.保持其他条件不变,升高温度,平衡时,![]() ,则
,则![]()
D.相同温度下,起始时向容器中充入0.10molA、0.10molB和0.30molC,达到平衡前的反应速率:v逆>v正
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.固体A由四种元素组成的化合物,为探究固体A的组成,设计并完成如实验:
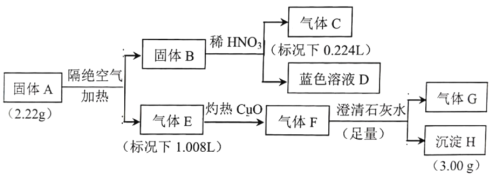
已知:固体B是一种单质,气体E、F都是G和另外一种气体组成。
请回答:
(1)组成A的四种元素是__________,气体E是__________。
(2)固体A隔绝空气加热分解的化学方程式是__________。
(3)蓝色溶液D和乙醇反应可获得固体A,同时还生成一种常见的温室气体,该反应的化学方程式为__________。
Ⅱ.某化学兴趣小组为探究SO2与![]() 溶液的反应,用如下装置(夹持、加热仪器略)进行实验:制备SO2,将SO2通入
溶液的反应,用如下装置(夹持、加热仪器略)进行实验:制备SO2,将SO2通入![]() 溶液中,迅速反应,得到无色酸性溶液和白色沉淀。
溶液中,迅速反应,得到无色酸性溶液和白色沉淀。
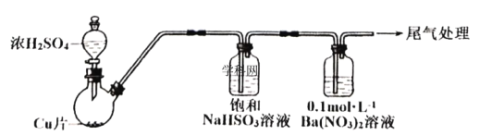
(1)SO2通入![]() 溶液中,得到无色酸性溶液和白色沉淀的离子方程式是__________。
溶液中,得到无色酸性溶液和白色沉淀的离子方程式是__________。
(2)若通入![]() 溶液中的SO2已过量,请设计实验方案检验__________。
溶液中的SO2已过量,请设计实验方案检验__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中物质的量浓度为1mol/L的是( )
A.将40g NaOH溶解在1L水中
B.将22.4L HCl气体溶于水配成1L溶液
C.将1L 10 mol/L浓盐酸加入9L水中
D.将10g NaOH溶于少量水,在稀释到溶液为250ml
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ·mol-1 ②N2H4(g)+O2(g)= N2(g)+2H2O(g) △H=-534kJ·mol-1下列关于肼和NO2反应的热化学方程式中,正确的是( )
A. 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l) △H= -1135.7kJ·mol-1
B. 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H= -1000.3kJ·mol-1
C. N2H4(g)+NO2(g)= ![]() N2(g)+2H2O(l) △H= -500.15kJ·mol-1
N2(g)+2H2O(l) △H= -500.15kJ·mol-1
D. 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H= -1135.7kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如图。W、X、Z分别位于不同周期,Z的原子半径在同周期元素中最大。(注:实线代表共价键,其他重复单元的W、X未标注)下列说法不正确的是( )
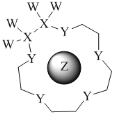
A.Y单质的氧化性在同主族中最强
B.离子半径:Z>Y
C.Z与Y可组成多种离子化合物
D.氢化物的热稳定性:Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向两只分别盛有50 mL0.100 mol/L盐酸的烧杯中各自匀速滴加50 mL蒸馏水、50 mL0.100 mol/L醋酸铵溶液,装置如图所示(夹持仪器等已略)。
已知:常温下,CH3COONH4溶液pH约为7。
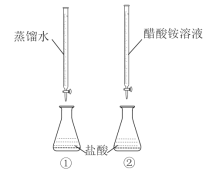
下列说法正确的是( )
A.实验①滴加过程中溶液所有离子浓度都减小
B.实验②滴至pH=2时,溶液中c(Cl-)+c(CH3COO-)+c(OH-)=0.01 mol/L
C.实验②滴加过程中,溶液中均存在c(CH3COO-)<c(NH4+)
D.滴定结束后,①中水的电离程度比②中大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿(FeS2)催化氧化的化学方程式为:2FeS2+7O2+2H2O 2FeSO4+2H2SO4。已知NA是阿伏加德罗常数的值,下列说法正确的是
2FeSO4+2H2SO4。已知NA是阿伏加德罗常数的值,下列说法正确的是
A.FeSO4和H2SO4都是离子化合物,均属于强电解质
B.0.1 mol·L-1 FeSO4 溶液中Fe2+离子的浓度为0.1 mol·L-1
C.FeSO4既是被氧化得到的产物,又是被还原得到的产物
D.当转移2 mol电子时,消耗氧气的体积(标准状况)约为22.4 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com