
【题目】某原子核外电子排布为3s23p7,它违背了( )
A.泡利原理B.能量最低原理C.洪特规则D.洪特规则特例
科目:高中化学 来源: 题型:
【题目】化学与社会、生活、科技等密切相关。下列说法正确的是
A. 石油经分馏后可以获得汽油、煤油、柴油、丁烯等含碳原子少的轻质油
B. 二氧化硅用途广泛,制光导纤维、石英坩埚、光电池等
C. 向氨水中逐滴加入5-6滴FeCl3饱和溶液,制得氢氧化铁胶体
D. 绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程:
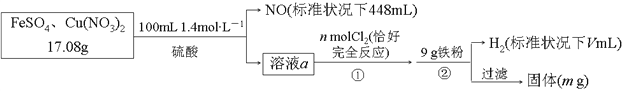
下列叙述中不正确的是
A. n=0.02 B. V=2240 C. m=3.2 D. 原混合物中FeSO4的质量分数约为89%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表1是元素周期表的一部分:
氧 | X |
Y | Z |
表1
数据编号 | 滴入NaOH溶液的体积/mL | 溶液的pH | |
HX | HZ | ||
① | 0 | 3 | 1 |
② | 20.00 | a | 7 |
表2
25℃时,用浓度为0.1000mol/L的氢氧化钠溶液分别滴定20.00 mL浓度均为0.1000mol/ L的两种酸HX、HZ(忽略溶液体积变化),实验数据如表2,下列判断正确的是
A. 表格中a<7
B. 25℃时,HX的电离常数Ka=1×10-6
C. Y和Z两元素的简单氢化物受热分解,前者分解温度高
D. 0.1000mol/L Na2Y的水溶液中:c(Y2-)+c(HY-)+c(H2Y)=0.1000mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为_________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________。
(2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有________(填仪器名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,电解质溶液中的下列关系式不正确的是
A. 已知A-+H2B(过量)==HA+HB-,则结合H+的能力:HB-<A-<B2-
B. 在0.1mol·L-1的氨水中滴加0.1 mol·L-1盐酸,恰好完全中和时, c(NH4+)+c(NH3 H2O)=0.05 mol·L-1
C. 将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数ka=![]()
D. 将0.2 mol·L-1盐酸与0.1 mol·L-1的KAlO2溶液等体积混合,溶液中离子浓度由大到小的顺序:c(Cl-)> c(K+)> c(Al3+)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.H2O分子中氧原子为sp2杂化,其分子几何构型为V形
B.配合物中,中心离子与配体间、配离子与酸根离子间都是以配位键结合
C.配离子中,中心离子提供空轨道,配体提供孤对电子对
D.NH4+是平面四边形结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢(H2O2)俗称双氧水。是一种重要的化工产品,具有漂白、氧化、消毒、杀菌等多种功效,广泛应用于纺织、造纸、化工、电子、轻工、污水处理等工业。回答下列问题:
(1) H2O2的电子式为_______________。
(2)用H2O2与稀硫酸的混合溶液可溶出印刷电路板金属粉末中的铜。
已知:Cu(s)+2H+ (aq)==Cu2+(aq) + H2(g) H= +64 kJ/mol
2H2O2(1) ==2H2O(l)+O2(g) H =-196 kJmol
H2(g) + l/2O2(g) ==H2O(l) H =-286 kJ/mol
则在稀硫酸溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为:__________________。
(3)工业上常用电解硫酸氢铵水溶液的方法制备过氧化氢,其原理为:首先2NH4HSO4![]() (NH4)2S2O8+ H2↑,然后由(NH4)2 S2O8水解得到H2O2和另一产物。则:
(NH4)2S2O8+ H2↑,然后由(NH4)2 S2O8水解得到H2O2和另一产物。则:
①电解时阳极的电极反应式为___________________;
②(NH4)2 S2O8水解时发生反应的化学方程式为 ____________________。
(4)现甲、乙两个化学小组利用两套相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素(仅一个条件改变)。甲小组有如下实验设计方案。
实验编号 | 温度 | 催化剂 | 浓度 |
甲组实验I | 25℃ | 三氧化二铁 | 10mL 5% H2O2 |
甲组实验II | 25℃ | 二氧化锰 | 10 mL 5% H2O2 |
甲、乙两小组得出如下图数据。
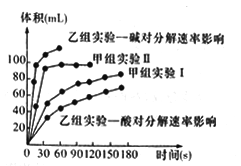
①甲小组实验得出的结论是______________________。
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析,相同条件下H2O2在________(填“酸”或“碱”)性环境下放出气体速率较快;由此,乙组提出可以用BaO2固体与硫酸溶液反应制H2O2,其反应的离子方程式为_______________;支持这一方案的理由是_______________________。
③已知过氧化氢还是一种极弱的二元酸:H2O2![]() H++HO2-(Ka1=2.4×10-12)。当稀H2O2溶液在碱性环境下分解时会发生反应H2O2+OH-
H++HO2-(Ka1=2.4×10-12)。当稀H2O2溶液在碱性环境下分解时会发生反应H2O2+OH-![]() HO2-+H2O,该反应中,正反应速率为V正=k正c(H2O2) c(OH- ),逆反应速率为v逆=k逆c(H2O) c(HO2-),其中k正、k逆为速率常数,则k正与k逆的比值为_________(保留3位有效数字)。
HO2-+H2O,该反应中,正反应速率为V正=k正c(H2O2) c(OH- ),逆反应速率为v逆=k逆c(H2O) c(HO2-),其中k正、k逆为速率常数,则k正与k逆的比值为_________(保留3位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com