
【题目】Ag/A12O3催化剂在工业上具有广泛用途。废银催化剂中银的回收既可节约资源,又有较好的经济效益。回收银的简化流程如下图所示(部分条件和试剂略):

请回答下列问题:
(1)第I步中,载体A12O3不与稀硝酸反应。Ag和稀硝酸反应产生的气体是____________。
(2)第II步中,饱和食盐水由工业食盐水提纯而得。除去工业食盐水中的少量Na2SO4、MgC12、CaC12杂质,正确的操作顺序是_________(填字母编号)。
a.加入稍过量的NaOH溶液
b.加入稍过量的BaC12溶液
c.过滤
d.加入稍过量的Na2CO3溶液
e.加入适量盐酸
(3)第III步中,加入氨水使沉淀溶解的离子方程式是____________ 。
(4)N2H4具有还原性,氧化产物为N2。第IV步反应的产物除Ag和N2外,还有的物质是_______(填化学式)。
(5)N2H4可用作火箭推进剂。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g) △H = -534 kJ/mol
2NO(g)+O2(g)=2NO2(g) △H = -116 kJ/mol
N2(g)+O2(g)=2NO(g) △H = +183 kJ/mol
N2H4和NO2反应生成N2和气态H2O的热化学方程式是______________________。
(6)Ag可制备银锌纽扣电池正极材料Ag2O,碱性条件下该电池的正极反应式是____。
(7)若上述流程中第I、II、III步银的回收率均为90%,则处理以a kg含银b%的废银催化剂,理论上需要加入N2H4的质量是________kg。
【答案】
(1) NO或一氧化氮
(2) abdce或badce或bdace;
(3) AgCl+ 2NH3·H2O=[Ag(NH3)2]++Cl-+ 2H2O;
(4) NH4Cl、NH3或NH3·H2O;
(5) 2N2H4(1)+ 2NO2(g)=3N2(g)+4H2O(g) △H=-1135 kJ/mol;
(6) Ag2O+ H2O+2e-= 2Ag+ 2OH-
(7) 5.4×l0-4ab
【解析】
试题分析:在Ag/A12O3中加稀硝酸生成硝酸银,过滤,在滤液中加饱和食盐水,生成氯化银沉淀,过滤,滤渣为AgCl,把AgCl溶解在氨水中,然后加N2H4还原得到Ag。
(1)第Ⅰ步中,载体A12O3不与稀硝酸反应,Ag与稀硝酸反应生成硝酸银和NO;故答案为:NO;
(2)除去工业食盐水中的少量Na2SO4、MgC12、CaC12杂质,先加碳酸钠除去CaC12、再加氯化钡除去Na2SO4和多余的碳酸钠,NaOH用于除去MgC12可前可后,只有顺序在过滤操作之前即可,过滤后,然后加盐酸,所以操作顺序为:abdce或badce或bdace;故答案为:abdce或badce或bdace;
(3)AgCl溶于氨水生成银氨络离子,其反应的离子方程式为:AgCl+2NH3H2O=[Ag(NH3)2]++Cl-+2H2O;故答案为:AgCl+2NH3H2O=[Ag(NH3)2]++Cl-+2H2O;
(4)银氨溶液中加N2H4,N2H4具有还原性,氧化产物为N2,还原产物为Ag,反应方程式为:4[Ag(NH3)2]Cl+N2H4=4Ag+N2+4NH4Cl+4NH3,则产物除Ag和N2外,还有的物质是NH4Cl、NH3;故答案为:NH4Cl、NH3;
(5)N2H4(1)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol①,2NO(g)+O2(g)=2NO2(g)△H=-116kJ/mol②,
N2(g)+O2(g)=2NO(g)△H=+183kJ/mol③,根据盖斯定律:①×2-②-③得:
2N2H4(1)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135 kJ/mol;;
(6)碱性条件下,Ag2O2在正极上得电子生成Ag和氢氧根离子,其电极反应式为Ag2O2+2H2O+4e-=2Ag+4OH-;故答案为:Ag2O2+2H2O+4e-=2Ag+4OH-;
(7)第Ⅰ、Ⅱ、Ⅲ步银的回收率均为90%,则处理以a kg含银b%的废银催化剂,则Ag的质量为a×b%×90%×90%×90%=7.29ab×10-4kg,已知4[Ag(NH3)2]Cl+N2H4=4Ag+N2+4NH4Cl+4NH3,
则 4Ag~~~~~~~~N2H4
4×108 32
7.29ab×10-4kg m(N2H4)
所以m(N2H4)=![]() =5.4×l0-4abkg;故答案为:5.4×l0-4ab。
=5.4×l0-4abkg;故答案为:5.4×l0-4ab。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于碱金属的叙述正确的是 ( )
A. 随着核电荷数增加,它们的密度逐渐减小
B. 随着核电荷数增加,单质的熔点、沸点升高
C. 随着核电荷数的增加,单质与水反应的剧烈程度增大
D. 随着核电荷数增加,离子的氧化性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构式如图所示:
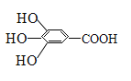
(1)用没食子酸制造墨水主要利用了 类化合物的性质。
A.醇 B.酚 C.油脂 D.羧酸
(2)没食子酸正丙酯具有抗氧化作用,是目前广泛应用的食品添加剂,其结构简式为 。
(3)尼泊金酯是对羟基苯甲酸与醇形成的酯类化合物,是国家允许使用的食品添加剂。尼泊金丁酯的分子式为______________,其苯环只与—OH和—COOR两类取代基直接相连且两个取代基位于苯环对位的同分异构体有 种。
(4)写出尼泊金乙酯与氢氧化钠溶液加热反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
B. 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=NH3·H2O+Al(OH)3↓+2BaSO4↓
C. 氢氧化钠溶液吸收足量SO2气体:SO2 + 2OH-=SO32- + H2O
D. 标准状况下,将1.12LCO2气体通入1L0.1mol/L的NaAlO2溶液中:CO2+2H2O+AlO2—=Al(OH)3↓+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语错误的是 ( )
A.硫离子的核外电子排布式:1s22s22p6
B.碳原子的外围电子轨道表示式:![]()
C.碳﹣14的原子组成符号:![]() C
C
D.Cl﹣的结构示意图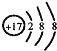
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与用途的对应关系不正确的是( )
选项 | 性质 | 用途 |
A | 氧化铁呈红棕色 | 红色涂料 |
B | 氧化铝熔点很高 | 耐火材料 |
C | 浓硫酸具有脱水性 | 干燥剂 |
D | 液氨汽化时要吸收大量的热 | 制冷剂 |
A.A B.B C.C D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是有关SO2、Cl2的性质实验。
某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
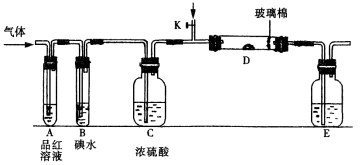
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若D中盛铜粉,通入足量的Cl2,D中的现象是___________;若装置D中装的是五氧化二钒(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 。
②SO2通入B中,碘水褪色,则该反应的离子方程式为 。
③E中盛有______________溶液。
某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母) ,则可以看到白色沉淀产生。
A.氨水 B.硝酸钠溶液 C.氯化钙溶液
若由元素S和O组成–2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“北京烤鸭”举世闻名.制作烤鸭套餐的部分原料如下:①鸭肉、②面粉、③黄瓜、④食盐.请回答:
(1)富含淀粉的是 (填序号,下同).
(2)富含蛋白质的是 .
(3)富含维生素的是 .
(4)属于调味剂的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.石油裂化、石油分馏、煤的气化、石油中提取石蜡都是化学变化
B.汽油、柴油、植物油都是碳氢化合物
C.实验事实证明乙酸乙酯中少量乙醇可以用水洗方法除去,其原理与溴水中加四氯化碳萃取溴类似
D.除去甲烷气体中的乙烯可以将混合气体通过盛有足量酸性高锰酸钾溶液的洗气瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com