
分析 (1)HCl是强电解质,故0.1mol/L的盐酸溶液中,c(H+)=0.1mol/L,根据水的离子积求出溶液中c(OH-),而溶液中的氢氧根全部来自于水的电离,且水电离出的c(H+)=c(OH-),据此分析计算;
(2)100℃时,Kw=10-12,NaOH溶液中,氢氧根基本全部来自于氢氧化钠本身,故可知0.1mol/L的氢氧化钠溶液中c(OH-),继而可求出溶液中的c(H+),而溶液中的氢离子全部来自于水,且水电离出的c(H+)=c(OH-),据此分析计算.
解答 解:(1)HCl是强电解质,故0.1mol/L的盐酸溶液中,c(H+)=0.1mol/L,根据水的离子积求出溶液中c(OH-)=$\frac{1{0}^{-14}}{0.1}$=10-13mol/L,而溶液中的氢氧根全部来自于水的电离,且水电离出的c(H+)=c(OH-)=10-13mol/L,故答案为:0.1mol/L;10-13mol/L;10-13mol/L;
(2)100℃时,Kw=10-12,NaOH溶液中,氢氧根基本全部来自于氢氧化钠本身,故可知0.1mol/L的氢氧化钠溶液中c(OH-)=0.1mol/L,故溶液中的c(H+)=$\frac{1{0}^{-12}}{0.1}$=10-11mol/L,而溶液中的氢离子全部来自于水,且水电离出的c(H+)=c(OH-)=10-11mol/L,
故答案为:0.1mol/L;10-11mol/L;10-11mol/L.
点评 本题考查酸碱溶液中pH的相关计算,注意100℃时Kw=10-12,明确由水电离出的c(H+)=c(OH-)是解答本题的关键,题目难度中等.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:多选题
| A. | 混合气体中一定含有甲烷 | B. | 混合气体一定是甲烷和乙烯 | ||
| C. | 混合气体中一定含有乙烷 | D. | 混合气体可能是甲烷和乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
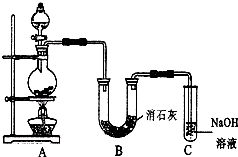 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (苯甲醛)+(CH3CO)2O(乙酸酐)$→_{140-170℃}^{K_{2}CO_{3}}$
(苯甲醛)+(CH3CO)2O(乙酸酐)$→_{140-170℃}^{K_{2}CO_{3}}$ (肉桂酸)+CH3COOH(乙酸)
(肉桂酸)+CH3COOH(乙酸)| 名称 | 分子量 | 性状 | 密度g/cm3 | 熔点℃ | 沸点℃ | 溶解度:克/100ml溶剂 | ||
| 水 | 醇 | 醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.06 | -26 | 178-179 | 0.3 | 互溶 | 互溶 |
| 乙酸酐 | 102 | 无色液体 | 1.082 | -73 | 138-140 | 12 | 溶 | 不溶 |
| 肉桂酸 | 148 | 无色结晶 | 1.248 | 133-134 | 300 | 0.04 | 24 | 溶 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com