
 (苯甲醛)+(CH3CO)2O(乙酸酐)$→_{140-170℃}^{K_{2}CO_{3}}$
(苯甲醛)+(CH3CO)2O(乙酸酐)$→_{140-170℃}^{K_{2}CO_{3}}$ (肉桂酸)+CH3COOH(乙酸)
(肉桂酸)+CH3COOH(乙酸)| 名称 | 分子量 | 性状 | 密度g/cm3 | 熔点℃ | 沸点℃ | 溶解度:克/100ml溶剂 | ||
| 水 | 醇 | 醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.06 | -26 | 178-179 | 0.3 | 互溶 | 互溶 |
| 乙酸酐 | 102 | 无色液体 | 1.082 | -73 | 138-140 | 12 | 溶 | 不溶 |
| 肉桂酸 | 148 | 无色结晶 | 1.248 | 133-134 | 300 | 0.04 | 24 | 溶 |

分析 (1)根据实验中为控制温度在140~170℃及选项的沸点进行判断;生成的乙酸酐有毒,且易挥发,所以该实验应在通风橱或通风处中进行操作;
(2)由于水蒸气蒸馏可以应用于分离和提纯有机物,所以图2中水蒸气蒸馏后产品在三颈烧瓶中;
(3)温度低肉桂酸钠的溶解度降低,会结晶析出晶体,所以趁热过滤的目的是防止肉桂酸钠结晶而析出堵塞漏斗;
(4)由于盐酸是强酸,所以加入1:1的盐酸的目的是使肉桂酸盐转化为肉桂酸;放入比布氏漏斗内径小的滤纸后,先由洗瓶挤出少量蒸馏水润湿滤纸,微启水龙头,稍微抽吸,使滤纸紧贴在漏斗的瓷板上,然后开大水龙头进行抽气过滤,所以选项B不正确;
(5)先根据表中密度计算出苯甲醛、乙酸酐的质量,再计算出它们的物质的量,然后理论上生成肉桂酸的质量,最后计算出肉桂酸的产率.
解答 解:(1)A、由于水的沸点只有100℃,不能通过水浴加热,故A错误;
B、由于甘油而的沸点高于170℃,故B正确;
C、沙子是固体,不便于控制温度,C错误;
D、由于植物油的沸点高于170℃,所以实验中为控制温度在140~170℃需在植物油中加热,故选BD;
生成的乙酸酐有毒,且易挥发,所以该实验应在通风橱或通风处中进行操作,
故答案为:BD;通风橱或通风处;
(2)水蒸气蒸馏可以应用于分离和提纯有机物,所以图2中水蒸气蒸馏后产品在三颈烧瓶中,
故答案为:三颈烧瓶;
(3)温度低,肉桂酸钠的溶解度降低,会结晶析出晶体,所以趁热过滤的目的是防止肉桂酸钠结晶而析出堵塞漏斗,具体的方法是用热过滤漏斗或采取保温措施,
故答案为:防止肉桂酸钠结晶而析出堵塞漏斗;用热过滤漏斗或采取保温措施;
(4)盐酸是强酸,所以加入1:1的盐酸的目的是使肉桂酸盐转化为肉桂酸;放入比布氏漏斗内径小的滤纸后,先由洗瓶挤出少量蒸馏水润湿滤纸,微启水龙头,稍微抽吸,使滤纸紧贴在漏斗的瓷板上,然后开大水龙头进行抽气过滤,所以选项B不正确,其余选项都是正确的,
故答案为:使肉桂酸盐转化为肉桂酸; ACD;
(5)5mL苯甲醛、14mL乙酸酐的质量分别是1.06g/ml×5ml=5.3g、14ml×1.082g/ml=15.148g,二者的物质的量分别是5.3g÷106g/mol=0.05mol、15.148g÷102g/mol=0.15mol,所以根据方程式可知,乙酸酐过量,则理论上生成肉桂酸的质量是0.05mol×148g/mol=7.4g,
所以产率是:$\frac{3.1g}{7.4g}$×100%=41.9%,
故答案为:41.9%.
点评 该题是高考中的常见题型,属于中等难度的试题.试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 先通二氧化碳、后通氨气、效果相同 | B. | 生成1mol(NH4)2SO4至少消耗2molNH3 | ||
| C. | CO2可被循环使用 | D. | 往甲中通CO2有利于制备(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
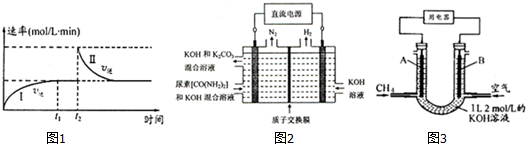
| 时间/min | 0 | 20 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
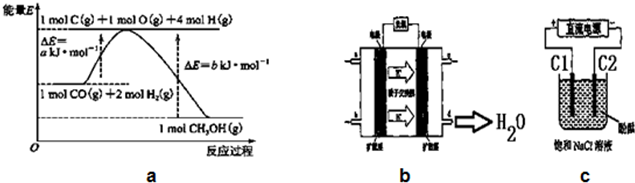
| 时间浓度(mol/L)温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O +HCl→
+HCl→ +KCl
+KCl
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,溶解 冷却、过滤, | 得到白色晶体和无色溶液 | -- |
| ② | 取少量滤液于试管中,滴入2-3滴AgNO3溶液 | 生成白色沉淀 | 滤液含有Cl- |
| ③ | 干燥白色晶体,加热使其融化,测其熔点 | 熔点为122.4℃ | 白色晶体是苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应制取H2后的溶液中:Na+、K+、AlO2-、Br- | |
| B. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | |
| C. | 苯酚钠溶液:H+、HCO3-、SO2、K+ | |
| D. | 氢氧化铝胶体:H+、K+、S2-、SO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com