
【题目】太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料有单晶硅,还有铜、锗、镓、硒等化合物。
(1)亚铜离子(Cu+)基态时电子排布式为_______________。,其电子占据的原子轨道数目为___________个。
(2)左下图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是_______________(填标号a,b,c)。

(3)单晶硅可由二氧化硅制得,二氧化硅晶体结构如上图所示,在二氧化硅晶体中,Si、 O原子所连接的最小环为十二元环,则每个Si原子连接 _________个十二元环。
(4)氮化镓(GaN)的晶体结构如右图所示。常压下,该晶体熔 点1700℃,故其晶体类型为_______;判断该晶体结构中存在配位键的依据是________________。
(5)与镓元素处于同一主族的硼元素具有缺电子性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-。[B(OH)4]-中B原子的杂化轨道类型为________________;不考虑空间构型,[B(OH)4]-中原子的成键方式用结构简式表示为_______________________;
(6)某光电材料由锗的氧化物与铜的氧化物按一定比例熔合而成,其中锗的氧化物晶胞结构如右图所示,该物质的化学式为________。已知该晶 体密度为ρg.cm-3,晶胞边长为a pm。则锗的相对原子质量为_____________(用含ρ和a的关系式表示)。
【答案】 1s22s22p63s23p63d10 14 b 12 原子晶体 GaN晶体中,毎1个Ga原子与4个N 原子结合,而Ga原子只有3个价电子,故需提供1个空轨道形成配位键 sp3 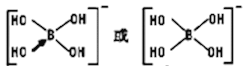 GeO 1/4ρa3NA10-30 -16
GeO 1/4ρa3NA10-30 -16
【解析】本题分析:本题主要考查原子结构与晶体结构。
(1)亚铜离子(Cu+)基态时电子排布式为1s22s22p63s23p63d10,其电子占据的原子轨道数目为14个。
(2)磷的化合价易呈+3,b曲线的第四电离能突增,所以表示磷的曲线是b。
(3)在二氧化硅晶体中,Si、O原子所连接的最小环为十二元环,则每个Si原子连接12个十二元环。
(4)常压下,该晶体熔点1700℃,故其晶体类型为原子晶体;判断该晶体结构中存在配位键的依据是GaN晶体中,毎1个Ga原子与4个N 原子结合,而Ga原子只有3个价电子,故需提供1个空轨道形成配位键。
(5)[B(OH)4]-中B原子的价层电子对是4,其杂化轨道类型为sp3;不考虑空间构型,[B(OH)4]-中原子的成键方式用结构简式表示为: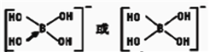 ;
;
(6)晶胞中含有4个氧原子,4个锗原子,该物质的化学式为GeO。设锗的相对原子质量为x,则GeO的相对分子质量为x+16,根据题可得4(x+16)=ρgcm-3×(acm×10-10)3NA,x=1/4ρa3NA10-30 -16。


科目:高中化学 来源: 题型:
【题目】将一块铝箔用砂纸打磨表面后,放置一段时间,在酒精灯上加热至熔化,下列说法正确的是( )
A. 熔化的是铝B. 熔化的是Al2O3
C. 熔化物滴落D. 熔化物迅速燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是
A. 晶体熔点的高低: >
>
B. 硬度由大到小:金刚石>碳化硅>晶体硅
C. 熔点由高到低:Na>Mg>Al
D. 晶格能由大到小:NaF>NaCl>NaBr>NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 molX气体跟amolY气体在体积可变的密闲容器中发生如下反应X( g) +aY(g)=bZ(g),反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
A. a = 2,b = 1 B. a=39,b =2 C. a=2,b = 2 D. a=3,b = 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O22SO3,并达到平衡.在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )
A. 等于p%B. 大于p%C. 小于p%D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃类化合物是重要的有机合成中间体。下面是某研究小组合成呋喃类化合物的路线:
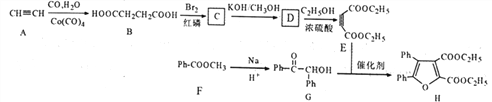
己知:①ph—为苯环
② 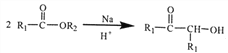
回答下列问题:
(1)下列能用于测定H结构的仪器有___________ 。(填序号)
a.核磁共振仪 b.红外光谱仪 c.质谱仪
(2)G中官能团名称为__________。
(3)E的化学名称是_______,B生成C的反应类型为_______________。
(4)写出由D生成E的化学方程式为___________________。
(5)含有羧基和两个苯环,且两个苯环不直接相连的G的同分异构体共有_____种(不含立体
结构),其中核磁共振氢谱显示为5组峰,峰面积比为4:4:2:1:1的是_____(写结构简式)。
(6)参照上述合成路线,以E和乙醇为原料(无机试剂任选),设计制备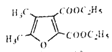 合成路线_______________________。
合成路线_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素; Z原子的最外层电子数是其最内层电子数的![]() ;W的最高正价和最低负价的代数和为0。下列说法正确的是
;W的最高正价和最低负价的代数和为0。下列说法正确的是
A. 原子半径:X<Y<Z<W
B. Z的氢化物中只含离子键
C. 最高价氯化物对应水化物的酸性:Y>W
D. X和W两种元素形成的化合物,既能与强酸反应又能与强碱反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com