
| A | B | C | D | |
| 化合物 | HCl | NaOH | Cu2(OH)2SO4 | FeSO4•7H2O |
| 氧化物 | H2O | Na2O | CO | Fe3O4 |
| 电解质 | 食盐水 | SO2 | H2SO4 | 铁 |
| A. | A | B. | B | C. | C | D. | D |
分析 单质:单质一定是纯净物,由同一种元素组成的纯净物是单质;
化合物:与单质相对,由两种或两种以上元素组成的纯净物叫做化合物.自然界中的物质大多数为化合物;
氧化物:其构成中只含两种元素,其中一种一定为氧元素,另一种若为金属元素,则为金属氧化物;若为非金属,则为非金属氧化物;
电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等;
非电解质:在水溶液中和熔融状态下都不能导电的化合物;例:有机物,非金属氧化物等.
解答 解:A.食盐水为混合物,既不是电解质也不是非电解质,故A错误;
B.二氧化硫本身不能电离产生自由移动的离子,属于非电解质,故B错误;
C.Cu2(OH)2SO4属于盐,是由两种以上元素组成的纯净物,属于化合物;CO含有两种元素,其中一种为氧元素,为氧化物;H2SO4在水溶液中能导电,属于电解质,故C正确;
D.铁为单质,既不是电解质也不是非电解质,故D错误;
故选:C.
点评 本题考查了物质的分类,明确化合物、氧化物、电解质、非电解质的相关概念是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1000 | 1100 |
| 平衡常数 | 0.68 | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 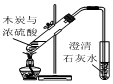 用如图所示装置验证反应产物二氧化碳 | |
| B. | 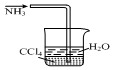 用如图装置吸收氨气并防止倒吸 | |
| C. |  如图装置配制100 mL 1 mol•L-1的硫酸 | |
| D. | 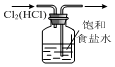 用如图装置除去氯气中的氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
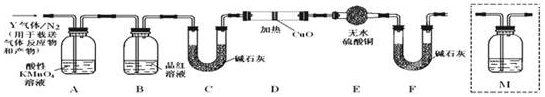
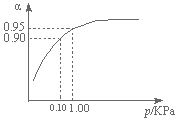
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
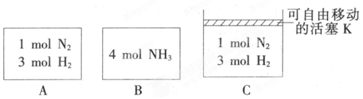
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成1 mol NaNO3需消耗0.4 mol KMnO4 | |
| B. | 反应过程中溶液的pH减小 | |
| C. | 该反应中NO${\;}_{2}^{-}$被还原 | |
| D. | X可以是盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
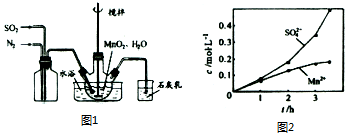
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2通常用于通讯行业 | |
| B. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔;而碳酸钠可作医疗上治疗胃酸过多的一种药剂 | |
| C. | 明矾可用作净水剂 | |
| D. | 金属钠可用于冶炼钛等金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com