
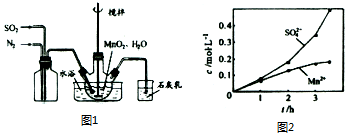
分析 (1)①根据题中所示的石灰乳的作用是吸收尾气二氧化硫,碱和酸性氧化物反应得到对应的盐和水,据此回答;
②根据实验的操作原则,为了让气体尽可能转化,要根据反应所需的条件和用量严格操作;
③考虑氮气的化学性质稳定,空气中氧气的活泼性等因素的影响;
(2)制取的原理是碳酸根和锰离子之间反应生成碳酸锰的过程,但要考虑MnCO3难溶于水、乙醇并在潮湿时易被空气氧化,100℃开始分解以及Mn(OH)2开始沉淀时pH=7.7等因素,过程中控制溶液的PH值以及洗涤沉淀所选的溶剂要小心,据此答题.
解答 解:(1)①石灰乳的作用是吸收尾气二氧化硫,碱和酸性氧化物反应得到对应的盐和水,反应方程式为:SO2+Ca(OH)2=CaSO3+H2O,
故答案为:SO2+Ca(OH)2=CaSO3+H2O;
②为使SO2尽可能转化完全,应定要保证控制反应的温度,在通入SO2和N2比例一定、不改变固液投料的条件下,要求所通气体一定要慢,故答案为:控制适当的温度;缓慢通入混合气体;
③氮气的化学性质稳定,空气中氧气性质活泼,在Mn2+催化作用下,易把亚硫酸氧化成硫酸,而使硫酸根浓度增大,故答案为:Mn2+催化氧气与亚硫酸反应生成硫酸;
(2)①因为Mn(OH)2开始沉淀时pH=7.7,所以A步骤中控制溶液PH<7.7的原因可能是防止生成Mn(OH)2沉淀,离子方程式为:Mn2++2OH-=Mn(OH)2↓,故答案为:Mn2++2OH-=Mn(OH)2↓;
②检验SO42-是否被洗涤干净,可以取最后一次洗涤的滤液少量于试管,加入用盐酸酸化的BaCl2溶液,若无明显现象,说明水洗合格,故答案为:取最后一次洗涤的滤液少量于试管,加入用盐酸酸化的BaCl2溶液,若无明显现象,说明水洗合格;
③用少量的乙醇洗涤,主要原因是乙醇容易挥发,便于低温干燥,防止MnCO3 受潮被氧化,受热分解,故答案为:乙醇容易挥发,便于低温干燥,防止MnCO3 受潮被氧化,受热分解.
点评 本题主要考查了制备高纯碳酸锰实验方案,读懂工艺流程,正确识图、理解离子反应的本质是解答的关键,本题实验综合性强,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L氯气与足量氢氧化钠溶艘反应转移的电子数为2NA | |
| B. | 将含有1molFeCl3的饱和溶液加入到沸水中得到氢氧化铁胶体,其中胶体粒子的数目为NA | |
| C. | 两份2.7g铝分别与100 mL浓度为2mol•L-1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3NA | |
| D. | 通常情况下,16g CH4中含有4NA个C-H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 化合物 | HCl | NaOH | Cu2(OH)2SO4 | FeSO4•7H2O |
| 氧化物 | H2O | Na2O | CO | Fe3O4 |
| 电解质 | 食盐水 | SO2 | H2SO4 | 铁 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3N4 晶体是分子晶体 | |
| B. | C3N4 晶体中微粒间通过离子键结合 | |
| C. | C3N4 晶体中C-N键的键长比金刚石中C-C键的键长要长 | |
| D. | C3N4 晶体中每个C原子连接4个N 原子,而每个N原子连接3个C原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
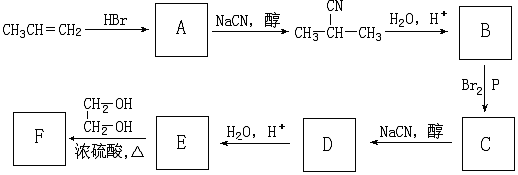
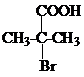 +NaCN$\stackrel{醇}{→}$NaBr+
+NaCN$\stackrel{醇}{→}$NaBr+ ,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$
,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$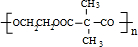 +2nH2O.
+2nH2O.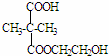 ,②分子内含有一个七元环
,②分子内含有一个七元环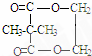 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水晶、玛瑙、红宝石、蓝宝石的主要成分都是非金属氧化物 | |
| B. | 蛋白质是结构复杂的高分子化合物,蛋白质的生物活性首先取决于蛋白质的一级结构 | |
| C. | 同位素示踪法是研究化学反应历程的手段之一,红外光谱法可用于研究有机物分子结构,滴定法不能用于测量盐类物质溶液的浓度 | |
| D. | 丁达尔现象可用于区别溶液与胶体,云、雾、稀硫酸均能产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论或目的 | |
| A | 向纯碱中滴加足量浓盐酸,将所得气体通入硅酸钠溶液中,溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
| B | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 该溶液中一定含有大量的SO42- |
| C | 取少量Fe(NO3)2试样加水溶液后加稀硫酸酸化,滴加KSCN溶液,溶液变为红色 | 该Fe(NO3)2试样已经变质 |
| D | 处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解 | 目的:将不溶于酸的沉淀转化为易溶于酸的沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g由${\;}_{6}^{12}$C60和${\;}_{6}^{14}$C60组成的固体中的原子数为NA | |
| B. | 4.4g由CO2和N2O组成的混合气体中的电子数为2.2NA | |
| C. | 常温常压下22.4LNH3中所含的共价键数为3NA | |
| D. | 1L1mol•L-1次氯酸溶液中的ClO-数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | N≡O | Cl-Cl | Cl-N | N=O |
| 键能/kJ.mol-1 | 630 | 243 | a | 607 |
| 序号 | c(ClNO)/mol.L-1 | v/mol.L-1•s-1 |
| ① | 0.30 | 3.60×10${\;}^{-{9}^{\;}}$ |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
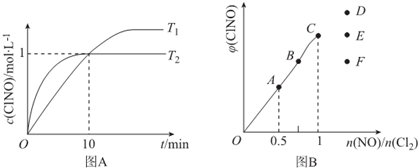
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com