
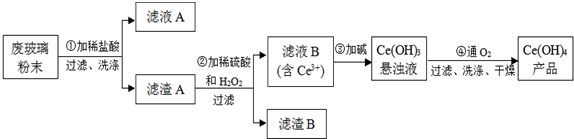
| 0.416g |
| 0.462g |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
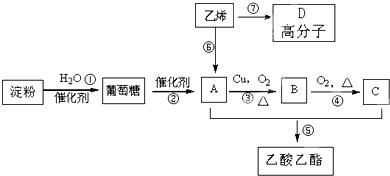
查看答案和解析>>
科目:高中化学 来源: 题型:
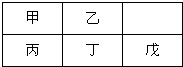 短周期金属元素甲-戊在元素周期表中的相对位置如图,下列判断正确的是( )
短周期金属元素甲-戊在元素周期表中的相对位置如图,下列判断正确的是( )| A、原子半径:丙<丁<戊 |
| B、戊只与强碱反应 |
| C、最高价氧化物对应水化物碱性:乙>丁>戊 |
| D、金属性:丙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴加石蕊显红色的溶液中:Na+、Fe2+、Cl-、NO3- | ||
B、
| ||
| C、c(H+)=10-12 mol?L-1的溶液:K+、Ba2+、Cl-、Br- | ||
| D、由水电离的c(H+)=1.0×10-13 mol?L-1的溶液中:K+、NH4+、AlO2-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
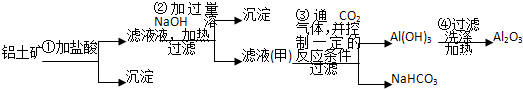
查看答案和解析>>
科目:高中化学 来源: 题型:
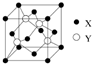 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子的核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子的核外电子共有16种运动状态.查看答案和解析>>
科目:高中化学 来源: 题型:
 地球上的元素大多数是金属,Na、Mg、Al是常见的主族金属元素,Fe和Cu是常见的过渡金属元素.它们在化学中占有极其重要的地位.
地球上的元素大多数是金属,Na、Mg、Al是常见的主族金属元素,Fe和Cu是常见的过渡金属元素.它们在化学中占有极其重要的地位.查看答案和解析>>
科目:高中化学 来源: 题型:
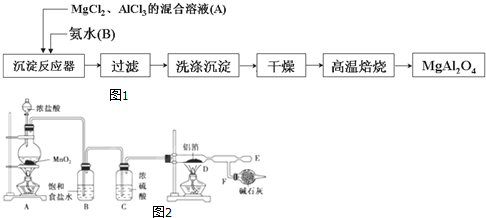
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
| B、钠和水反应:2Na+2H2O=2Na++2OH-+H2↑ |
| C、向NaHCO3溶液中滴入少量稀硫酸:2H++CO32-=CO2↑+H2O |
| D、盐酸中加入氢氧化镁:H++OH-=H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com