
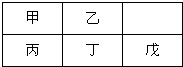
 短周期金属元素甲-戊在元素周期表中的相对位置如图,下列判断正确的是( )
短周期金属元素甲-戊在元素周期表中的相对位置如图,下列判断正确的是( )| A、原子半径:丙<丁<戊 |
| B、戊只与强碱反应 |
| C、最高价氧化物对应水化物碱性:乙>丁>戊 |
| D、金属性:丙>甲 |


科目:高中化学 来源: 题型:
| A、钠在氯气中燃烧,生产食盐 |
| B、二氧化锰和浓盐酸共热,制取氯气 |
| C、氯气与消石灰反应,生产漂白粉 |
| D、氢气和氯气混合见光爆炸制氯化氢,再生产盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由于燃烧均为放热反应,所以石墨为重要的能源 |
| B、由于燃烧反应放热,所以△H1和△H2均取正值 |
| C、由于石墨和金刚石同为碳元素组成,所以△H1=△H2 |
| D、由于石墨和金刚石属于不同的单质,所以△H1和△H2不等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
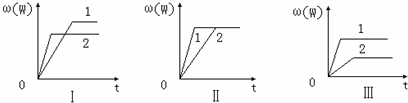
| A、图Ⅰ可能是不同压强对反应的影响,且P2>P1,a>n |
| B、图Ⅱ可能是在同温同压下催化剂对反应的影响,且2使用的催化剂效果好 |
| C、图Ⅱ可能是不同压强对反应的影响,且P1>P2,n=a+b |
| D、图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
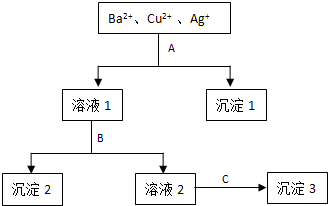
查看答案和解析>>
科目:高中化学 来源: 题型:
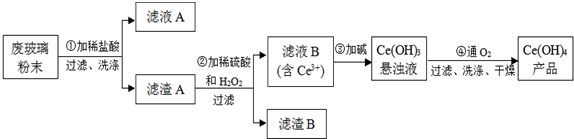
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com