
【题目】现有原子序数之和为51的5种短周期元素A,B,C,D,E。已知A的单质在常温下为无色气体;B原子的最外层电子数比次外层电子数多3个;C和B属于同一主族;D的最高正价与负价的代数和为4,其最高价氧化物对应的水化物的酸性在同主族元素中最强,E元素最外层电子数与其K层电子数相同。
(1)试写出它们的元素符号。__________________________________________。
(2)写出B的氢化物的电子式_____________________________。
(3)由A、D两种元素形成的化合物是________化合物(填“离子”或“共价”),化合物内存在________键(填“离子”或“共价”)。
(4)由D、E两种元素形成的化合物的电子式为________,它属于________化合物,化合物内存在________键。
(5)下列关于A,B,C,D,E 5种元素形成的物质的有关叙述正确的是________(多选)。
a.A,B,C,D都能通过共价键形成单质,其中B形成的单质性质最稳定,是因为其原子半径最小
b.A,B,D 3种元素为非金属元素,它们共同组成的化合物一定是共价化合物
c.B,E形成的化合物E3B2应为离子化合物
d.5种元素两两组合形成的化合物中既有共价化合物,又有离子化合物
e.5种元素形成简单离子的离子半径大小为C>D>B>E>A
【答案】H、N、P、S、Mg  共价 共价
共价 共价 ![]() 离子 离子 cde
离子 离子 cde
【解析】
B原子的次外层只能为K层,所以B为氮,C为磷,最高正价和负价的代数和为4时,只有最高正价为+6价,负价为-2价,即ⅥA族元素符合,因其最高价含氧酸的酸性在本主族元素的含氧酸中最强,所以D元素为硫,E为镁,再由原子序数之和为51,而B,C,D,E原子序数均已知,则A肯定为氢元素;结合以上分析;
B原子的次外层只能为K层,所以B为氮,C为磷,最高正价和负价的代数和为4时,只有最高正价为+6价,负价为-2价,即ⅥA族元素符合,因其最高价含氧酸的酸性在本主族元素的含氧酸中最强,所以D元素为硫,E为镁,再由原子序数之和为51,而B,C,D,E原子序数均已知,则A肯定为氢元素,
(1)结合以上分析可知:A,B,C,D,E五种元素的符号分别为:H、N、P、S、Mg;综上所述,本题答案是:H、N、P、S、Mg。
(2)B的氢化物为氨气,其为共价化合物,电子式为: ;综上所述,本题答案是:
;综上所述,本题答案是: 。
。
(3) 由A、D两种元素形成的化合物为硫化氢,属于共价化合物;化合物内存在共价键;
综上所述,本题答案是:共价;共价。
(4) 由D、E两种元素形成的化合物硫化镁,为离子化合物,电子式为![]() ;化合物内存在离子键;
;化合物内存在离子键;
综上所述,本题答案是:![]() ;离子;离子。
;离子;离子。
(5)a.H形成的单质为氢气,N可以形成的单质氮气,P可以形成单质白磷和红磷,S可以形成单质硫磺,它们都是通过共价键构成的。N形成的单质氮气最稳定,氮气中氮原子间通过氮氮三键相连的,叁键的键能较大,故而最稳定。a错误。
b.H、N、S均为非金属元素,但它们构成化合物如(NH4)2S和NH4HS属于离子化合物,b错误。
c.N和Mg形成的Mg3N2属于离子化合物,c正确。
d.H、N、P、S两两形成的化合物为共价化合物,H、N、P、S分别和Mg构成的化合物是离子化合物,d正确。
e.H离子半径最小,N、Mg比S、P形成的简单离子半径要小;N、Mg形成的简单离子具有相同电子层结构,核电荷数越大半径越小,所以N比Mg形成的简单离子半径大;同理S、P形成的简单离子具有相同电子层结构,核电荷数越大半径越小,所以S比P形成的简单离子半径小;e正确。
综上所述,本题选cde。


科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。

请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:_________________________。
(2)海水提溴,制得1molBr2至少需要消耗_________molCl2。步骤Ⅲ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为_________。
(3)用四氯化碳可以将生成的溴提取出来,利用了溴的________性质,为了除去产物中残留的少量Cl2,可向其中加入_________溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:p[c(HX)/c(X-)]=-lg[c(HX)/c(X-)]。室温下,向0. 10 mol/LHX溶液中滴加0.10 mol/L NaOH溶液,溶液pH随p[c(HX)/c(X-)]变化关系如图。下列说法不正确的是
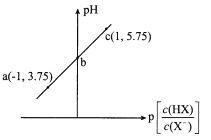
A. 溶液中水的电离程度:a<b<cB. 图中b点坐标为(0,4.75)
C. c点溶液中:c(Na+) =l0c(HX)D. 室温下HX的电离常数为10-4. 75
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构.其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数.分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ、分子中价层电子对之间的斥力的主要顺序为:
i、孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力;
ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;
iii、X原子得电子能力越弱,A﹣X形成的共用电子对之间的斥力越强;
iv、其他.
请仔细阅读上述材料,回答下列问题:
(1)根据要点I可以画出AXnEm的VSEPR理想模型,请填写下表__:

(2)H2O分子的立体构型为:__,请你预测水分子中∠H﹣O﹣H的大小范围__;
(3)SO2Cl2和SO2F2都属AX4E0型分子,S=O之间以双键结合,S﹣Cl、S﹣F之间以单键结合.请你预测SO2Cl2和SO2F2分子的立体构型:__,SO2Cl2分子中∠Cl﹣S﹣Cl__(选填“<”、“>”或“=”)SO2F2分子中∠F﹣S﹣F。
(4)用价层电子对互斥理论(VSEPR)判断SO32﹣离子的空间构型:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HZO4![]() H2YO4
H2YO4 ![]() H3XO4,下列判断正确的是 ( )
H3XO4,下列判断正确的是 ( )
①阴离子的还原性按X、Y、Z顺序减弱
②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小
④气态氢化物的稳定性按X、Y、Z顺序减弱
①②A. ②③ B. ①②③ C. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. CHCl3+HF → CHFCl2+HCl 属于取代反应
B. 煤气化生成 CO 和H2,再经过催化合成可以得到甲醇等液体燃料
C. 石油裂解气和SO2 都能使 KMnO4 溶液褪色,褪色原理不同
D. 苯在一定条件下能与H2 发生加成反应,也能与氯气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式__________。
(2)已知在25℃、101kPa下,1 g乙醇在氧气中充分燃烧生成二氧化碳和液态水释放出29.7 kJ的热量,试写出乙醇燃烧热的热化学方程式_______________。
(3)标准状况下,4.48L H2在足量O2中完全燃烧放出热量Q kJ,写出H2燃烧的热化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是

①m+n>p ②x点表示的正反应速率大于逆反应速率
③n>p ④x点比y点时的反应速率慢
⑤若升高温度,该反应的平衡常数增大
A. ①②⑤ B. 只有②④ C. 只有①③ D. ①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com