
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。

请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:_________________________。
(2)海水提溴,制得1molBr2至少需要消耗_________molCl2。步骤Ⅲ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为_________。
(3)用四氯化碳可以将生成的溴提取出来,利用了溴的________性质,为了除去产物中残留的少量Cl2,可向其中加入_________溶液。
【答案】Ca2++CO32-=CaCO3↓ Ba2++ CO32-=BaCO3↓ 2 Br2+SO32-+H2O=SO42-+2H++2Br- 易溶于有机溶剂 NaBr(或溴化钠)
【解析】
本题主要考查海水资源的利用。
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,可依次加入过量BaCl2溶液(除去SO42-)、NaOH溶液(除去Mg2+)、Na2CO3溶液(除去多余的Ba2+和溶液中的Ca2+)、再加入适量稀盐酸(除去多余的Na2CO3),据此作答;
(2)根据流程可知,步骤II、蒸馏过程中加入Cl2,结合氧化还原反应分析;步骤Ⅲ若用Na2SO3水溶液吸收Br2,Br2具有氧化性,SO32-具有还原性,发生氧化还原反应,据此写出离子方程式;
(3)溴单质易溶于有机溶剂;Cl2具有氧化性,可与Br-发生氧化还原反应。
(1)据上述分析可知,加入Na2CO3溶液的目的是除去多余的Ba2+和溶液中的Ca2+,故加入Na2CO3溶液后相关化学反应的离子方程式为:Ca2++CO32-=CaCO3↓,Ba2++ CO32-===BaCO3↓;
(2)流程中海水提溴,先向母液中通入Cl2将Br-氧化为Br2,再用SO2将其还原为Br-,最后再通入Cl2将Br-氧化为Br2,所以制得1molBr2需要消耗2molCl2;步骤Ⅲ若用Na2SO3水溶液吸收Br2,Br2具有氧化性,SO32-具有还原性,发生氧化还原反应,反应的离子方程式为:Br2+SO32-+H2O=SO42-+2H++2Br-;
(3)溴单质在水中溶解度小于在四氯化碳中的溶解度,故用四氯化碳将生成的溴提萃取出来,利用了溴易溶于有机溶剂的性质;产物为溴单质,若含有少量Cl2,故可加入NaBr溶液将Cl2还原,并生成Br2,再经过后续操作得到高纯度Br2。


科目:高中化学 来源: 题型:
【题目】利用废铁屑(主要成分为Fe,还含有C,S,P等)制取高效净水剂K2FeO4流程如图:

下列说法不正确的是
A. 废铁屑在酸溶前可用热的纯碱溶液去油污
B. 步骤②是将Fe2+转化为Fe(OH)3
C. 步骤③中发生的反应的离子方程式为2Fe(OH)3+3ClO-=FeO42-+3Cl-+4H++H2O
D. 步骤④中反应能发生的原因是在相同条件下,K2FeO4的溶解度小于Na2FeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲醛和苯酚为主要原料,经下列转化可合成酚醛树脂和重要的有机合成中间体D(部分反应条件和产物已略去)

已知:R1CH2COOCH2+R2COOCH3![]() CH3OH+
CH3OH+
请回答下列问题:
(1)反应①的反应类型为___________;A的化学名称为___________。
(2)C中所含官能团的名称为___________;D的分子式为___________。
(3)反应②的化学方程式为______________________。
(4)A的下列性质中,能反映支链对苯环结构产生影响的是___________(填字母)。
a.能与氢氧化钠溶液反应
b.能使酸性高锰酸钾溶液褪色
c.向稀溶液中加入浓溴水后,产生沉淀
(5)芳香化合物E(C8H10O2)与B的水解产物互为同分异构体,1molE可与2 mol NaOH反应,其核磁共振氢谱中有3组峰且峰面积之比为3:1:1,则E有___________种可能的结构(不考虑立体异构)。
(6)以CH3OH和CH3ONa为原料(其他试剂任选),设计制备CH3COCH2 COOCH3的合成路线:CH3OH![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物中碳原子和氢原子个数比为3∶4,不能与溴水反应却能使KMnO4酸性溶液褪色。其蒸气密度是相同状况下甲烷密度的7.5倍。在铁存在时与溴反应,能生成两种一溴代物。该有机物可能是( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述中正确的是
A. 0.1 molKI与0.1 molFeC13在溶液中反应转移的电子数为0.1NA
B. 镁条在氮气中完全燃烧,生成50g氮化镁时,有1.5NA共用电子对被破坏
C. 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA
D. 标况时,22.4L二氯甲烷所含有的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。硫酸厂的酸性废水中砷(As)元素(主要以H3AsO3形式存在)含量极高,为控制砷的排放,某工厂采用化学沉淀法处理含砷废水。请回答以下问题:
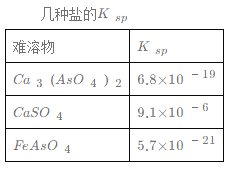
(1)若酸性废水中Fe3+的浓度为1.0×10-4 mol·L-1,则c(AsO43-)不超过 ____mol·L-1。
(2)工厂排放出的酸性废水中的三价砷(弱酸H3AsO3)不易沉降,可投入MnO2先将其氧化成五价砷 (弱酸H3AsO4),此时MnO2被还原为Mn2+,该反应的离子方程式为_________________。
(3)砷酸(H3AsO4)分步电离的平衡常数(25 ℃)为Ka1=5.6×10-3,Ka2=1.7×10-7,Ka3=4.0×10-12,第三步电离的平衡常数表达式为Ka3=_________,Na3AsO4第一步水解的离子方程式为AsO43-+H2O![]() HAsO42-+OH-,该步水解的平衡常数(25 ℃)为____。
HAsO42-+OH-,该步水解的平衡常数(25 ℃)为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A. 氯水使有色布条褪色,说明氯水中含有![]()
B. 向氯水中加入![]() 溶液产生白色沉淀,说明氯水中含有
溶液产生白色沉淀,说明氯水中含有![]()
C. 向氯水中加入![]() 粉末,有气泡产生,说明氯水中含有
粉末,有气泡产生,说明氯水中含有![]()
D. 向氢氧化钠溶液中滴加氯水,溶液黄绿色消失,说明氯水中含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬酸(用HR 表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是

A. H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B. pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C. Na2HR溶液中HR2-的水解程度大于电离程度
D. pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有原子序数之和为51的5种短周期元素A,B,C,D,E。已知A的单质在常温下为无色气体;B原子的最外层电子数比次外层电子数多3个;C和B属于同一主族;D的最高正价与负价的代数和为4,其最高价氧化物对应的水化物的酸性在同主族元素中最强,E元素最外层电子数与其K层电子数相同。
(1)试写出它们的元素符号。__________________________________________。
(2)写出B的氢化物的电子式_____________________________。
(3)由A、D两种元素形成的化合物是________化合物(填“离子”或“共价”),化合物内存在________键(填“离子”或“共价”)。
(4)由D、E两种元素形成的化合物的电子式为________,它属于________化合物,化合物内存在________键。
(5)下列关于A,B,C,D,E 5种元素形成的物质的有关叙述正确的是________(多选)。
a.A,B,C,D都能通过共价键形成单质,其中B形成的单质性质最稳定,是因为其原子半径最小
b.A,B,D 3种元素为非金属元素,它们共同组成的化合物一定是共价化合物
c.B,E形成的化合物E3B2应为离子化合物
d.5种元素两两组合形成的化合物中既有共价化合物,又有离子化合物
e.5种元素形成简单离子的离子半径大小为C>D>B>E>A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com