
| 1 |
| 2 |


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
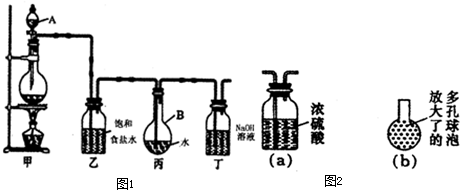
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2012届河北省石家庄市高三补充题、压轴题化学试卷(带解析) 题型:填空题
(14分)氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF H++F-。25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示。
H++F-。25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示。
已知:电离度( )和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力,
)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力, 。
。
请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[ (HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_______。
(HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_______。
a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水稀释
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:__ (保留两位有效数字),电离度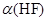 约为___ _%。
约为___ _%。
(3)已知在此温度下:
H+(aq)+OH-(aq)=H2O(1) △H=-a kJ?mol -1;
HF(aq)  H+(aq)+F-(aq) △H=+b kJ?mol -1
H+(aq)+F-(aq) △H=+b kJ?mol -1
则该过程中和反应的热化学方程式为:________________________________ ;在忽略F-水解的情况下,反应达到B点时,滴加过程中所释放的热量为________kJ(用只含a、b的式子表示)。
(4)下列有关图中各点微粒浓度关系正确的是_______________。
a.在A处溶液中:c(F—)+c(HF)="0.2" mol?L-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合: = Ka(HF)
= Ka(HF)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省石家庄市高三补充题、压轴题化学试卷(解析版) 题型:填空题
(14分)氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF H++F-。25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示。
H++F-。25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示。

已知:电离度( )和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力,
)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力, 。
。
请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[ (HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_______。
(HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_______。
a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水稀释
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:__
(保留两位有效数字),电离度 约为___
_%。
约为___
_%。
(3)已知在此温度下:
H+(aq)+OH-(aq)=H2O(1) △H=-a kJ•mol -1;
HF(aq)  H+(aq)+F-(aq) △H=+b kJ•mol -1
H+(aq)+F-(aq) △H=+b kJ•mol -1
则该过程中和反应的热化学方程式为:________________________________ ;在忽略F-水解的情况下,反应达到B点时,滴加过程中所释放的热量为________kJ(用只含a、b的式子表示)。
(4)下列有关图中各点微粒浓度关系正确的是_______________。
a.在A处溶液中:c(F—)+c(HF)=0.2 mol•L-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合: = Ka(HF)
= Ka(HF)
查看答案和解析>>
科目:高中化学 来源: 题型:
氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF![]() H++F-。25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示。
H++F-。25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示。
 已知:电离度(
已知:电离度(![]() )和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。
)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。![]()
请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[![]() (HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是__________。
(HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是__________。
a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水稀释
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:__ ,
电离度![]() 为_ _%。
为_ _%。
(3)下列有关图中各点微粒浓度关系正确的是_______________。
a.在A处溶液中:c(F—)+c(HF)=0.2 mol•L-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合:![]() = Ka(HF)
= Ka(HF)
(4)已知该温度下Ksp(CaF2)=1.5×10-10。取B点时的溶液10mL与90mL1×10-4 mol·L-1 CaCl2溶液混合,通过列式计算说明是否有沉淀产生。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com