
【题目】(1)已知反应2HI(g)=H2(g) + I2(g)的△H=+11kJ·mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(2)某温度下,浓度都是l mol/L的两种单质气体X2和Y2,在密闭容器中反应生成气体Z。达到平衡时,X2、Y2、Z的浓度分别为0.4mol/L、0.8mol/L、0.4mol/L则该反应的化学方程式是____________________________。
(3)对反应N2O4(g)![]() 2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是______。
2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是______。

a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A<C
d.由状态B到状态A,可以用加热的方法
【答案】299 3X2(g) +Y2(g)![]() 2Z(g) d
2Z(g) d
【解析】
(1)△H=反应物总键能—生成物总键能=2E(H—I)—436KJ—151KJ=11kJ,E(H—I)=299KJ;
(2)反应方程式中各物质的计量数之比等于各物质的浓度变化量之比,即n(X2):n(Y2):n(Z)==0.6:0.2:0.4=3:1:2,则该反应的化学方程式是3X2(g) + Y2(g)![]() 2Z(g) ;
2Z(g) ;
(3)由已知反应方程式可知,反应的正反应是吸热反应,所以温度升高平衡正向移动,NO2的体积分数增大,根据图像,压强相同时,A、B两点的NO2的体积分数A点更大,则说明温度T2>T1;A、C两点温度相同,C点压强大,平衡逆向移动,则C点反应速率>A点,N2O4的转化率A点大于C点;A、C两点温度相同,平衡常数相等,a、b、c错误,d正确。


科目:高中化学 来源: 题型:
【题目】化学与生活生产密切相关。下列说法中不正确的是
A. 施肥时,铵态氮肥不能与草木灰(含K2CO3)混合使用
B. 夏天冰箱保鲜食品的原理是降低温度,减小化学反应速率
C. 施用适量石膏(CaSO4·2H2O)可降低盐碱地(含较多NaCl、Na2CO3)的碱性
D. 将海水直接电解可获得 Mg及Cl2等单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列物理量不再变化时,不能表明反应:A(s)+2B(g)![]() C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
A.B的物质的量浓度B.混合气体的密度
C.混合气体的平均相对分子质量D.混合气体的压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
①m+n>p ②x点表示的正反应速率大于逆反应速率
③x点比y点时的反应速率慢 ④n>p
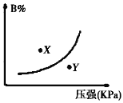
A. ①② B. ②④ C. ②③ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为______。
(2)反应前A的物质的量浓度是_______。
(3)10 s末,生成物D的浓度为______。
(4)A与B的平衡转化率之比为_______。
(5)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):
①降低温度____;
②增大压强____
③增大A的浓度_____;
④恒容下充入Ne______。
(6)下列叙述能说明该反应已达到化学平衡状态的是(填标号)_____;
A.v(B)=2v(C)
B.容器内压强不再发生变化
C.A的体积分数不再发生变化
D.器内气体密度不再发生变化
E.相同时间内消耗n mol的B的同时生成2n mol的D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)甲烷与水蒸气反应,被氧化的元素是____________(元素符号作答),当生成标准状况下35.84 L合成气时转移电子的物质的量是________。
(2)将2 mol CH4和5 mol H2O(g)通入容积为10 L的反应室,CH4的平衡转化率与温度、压强的关系如图所示。

①若达到A点所需的时间为5 min,则v(H2)=____________________。
②图中的p1______p2(填“<”“>”或“=”),A、B、C三点的平衡常数KA、KB、KC的大小关系是_______。
(3)合成气用于合成氨气时需除去CO,发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,下列措施中能使
CO2(g)+H2(g) ΔH<0,下列措施中能使![]() 增大的是________(选填编号)。
增大的是________(选填编号)。
A.降低温度 B.恒温恒容下充入He(g)
C.将H2从体系中分离 D.再通入一定量的水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白粉厂废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下:

已知:i.部分离子完全生成氢氧化物沉淀的pH
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的PH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)为保证产物TiO(OH)2的纯度,加入试剂A要适量。试剂A为___________。
(2)煅烧回收的TiO(OH)2,获得的TiO2会发黄,发黄的杂质可能是_______(填化学式)。
(3)滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有______________。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2+ +________+4H2O +H2O2 =_______ + 4NH3·H2O
(5)电解制备过二硫酸铵的装置如下图所示。

①S2O82-中S元素的化合价为+6,其中过氧键的数目为___________。
②电解时,铁电极连接电源的___________极。
③常温下,电解液中含硫微粒主要存在形式与 pH 的关系如下图所示。

在阳极放电的离子主要为HSO4-,阳极区电解质溶液的 pH 范围为______,阳极的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写错误的是
A. HCO3-的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. Cu2+的水解方程式:Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
C. NH4+的水解方程式:NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
D. CaCO3的电离方程式:CaCO3![]() Ca2++CO32-
Ca2++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是

A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com