
【题目】关于下列各实验装置的叙述中,正确的是

A. 装置①不可用于实验室制取少量NH3或O2
B. 可用从a处加水的方法检验装置②的气密性
C. 实验室可用装置③收集HCl
D. 验证溴乙烷发生消去反应生成烯烃的实验可利用装置④进行
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】如图表示配制100mL 0.10mol·L-1CuSO4溶液的几个关键实验步骤和操作,据图回答下列问题:
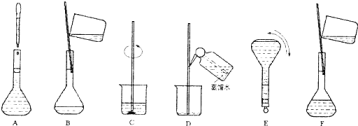
(1)将上述实验步骤A-F按实验过程先后次序排列 ______________________________。
若用CuSO45H2O晶体来配制480mL 0.20mol·L-1的溶液需称取CuSO45H2O 晶体的质量为_____ g。若所取的晶体已经有一部分失去了结晶水,则所配制的溶液浓度偏___________ (填“高”或“低”)。
(2)写出配制480mL0.20mol·L-1CuSO4溶液所需要用到的玻璃仪器的名称:烧杯、量筒、_______________。
(3)步骤B通常称为转移,若是配制NaOH溶液,用水溶解NaOH固体后未冷却至室温即转移,配制溶液的浓度将偏______(填“高”或“低”)。步骤A通常称为____________,如果俯视刻度线,配制的浓度将偏______(填“高”或“低”)。步骤D称为_______。若没有步骤D,则配制的浓度偏______(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VL Al2(SO4)3溶液中含a g Al3+,从中取出V/2L,并稀释至V L,则稀释后SO42—的物质的量浓度为
A. a/(54V)mol·L—1 B. a/(18V)mol·L—1 C. a/(36V)mol·L—1 D. a/(27V)mol·L—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列有关说法正确的是
A. 由地沟油加工合成的“生物柴油”与柴油成分相同
B. 煤的液化是将煤处理成清洁能源的一种物理方法,可减少PM2.5引起的危害
C. 海水提镁、炼铁、制造玻璃等工业都用到石灰石
D. 食盐中加碘单质可以减少碘缺乏症
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿斯巴甜(Aspartame,结构简式如图)具有清爽的甜味,甜度约为蔗糖的200倍。下列有关说法不正
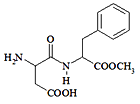 确的是
确的是
A. 阿斯巴甜在一定条件下既能与酸反应、又能与碱反应
B. 阿斯巴甜分子中有2个手性碳原子
C. 分子式为:C14H18N2O5,阿斯巴甜属于蛋白质
D. 阿斯巴甜的水解产物中有两种氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用AG表示溶液的酸度,其表达式为![]() 。室温下,实验室里用0.1mol·L-1的盐酸滴定10mL0.1mol·L-1MOH溶液,滴定曲线如图所示。下列说法正确的是
。室温下,实验室里用0.1mol·L-1的盐酸滴定10mL0.1mol·L-1MOH溶液,滴定曲线如图所示。下列说法正确的是
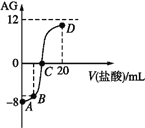
A. MOH为强碱
B. C点时加入盐酸的体积等于10mL
C. 若B点加入的盐酸体积为5mL,所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH-)
D. 滴定过程中从A点到D点溶液中水的电离程度:A<B<C<D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。有关该反应下列叙述正确的是
2AlN+3CO。有关该反应下列叙述正确的是
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1 mol AlN需转移3 mol电子
C. AlN中氮的化合价为+3
D. AlN的摩尔质量为41 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污
泥中Cr(Ⅲ)的处理工艺流程如下:

已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制480 mL 2 mol·L-1的硫酸,需量取浓硫酸___mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需____________________________。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:
___________________________________________。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为__________(填微粒的化学式)
(4)钠离子交换树脂的反应原理为:Mn+ + n NaR = MRn + n Na+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有__________________。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式______________________________。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-浓度,可用标准AgNO3溶液滴定待测液,已知:
银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 黄 | 白 | 砖红 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定时可选为滴定指示剂的是____(选填编号),滴定终点现象是________________________。
A.NaCl B.K2CrO4 C.KI D.NaCN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质的有关叙述中正确的是( )
A. 乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色
B. 乙酸与乙醇可以发生酯化反应,又均可与金属钠发生置换反应
C. 分馏、干馏都是物理变化,裂化、裂解都是化学变化
D. 纤维素![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com