
【题目】将一定质量的镁、铜合金加入到稀硝酸中,合金完全溶解,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3mol/L的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述正确的是( )
A.反应中转移电子的总数为0.3mol
B.反应过程中,消耗硝酸的物质的量为0.3mol
C.沉淀完全时消耗NaOH溶液的体积为100mL
D.开始加入合金的质量可能为3.4g
【答案】A
【解析】解:将镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3 , 沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为:n(OH﹣)= ![]() =0.3mol,根据反应方程式可知,镁和铜的总的物质的量为:n=
=0.3mol,根据反应方程式可知,镁和铜的总的物质的量为:n= ![]() ×n(OH﹣)=0.15mol,
×n(OH﹣)=0.15mol,
A.根据分析可知,反应中注意电子的物质的量=氢氧根离子的物质的量﹣0.3mol,故A正确;
B.根据方程式可知参加反应的n反应(HNO3)= ![]() (金属)=
(金属)= ![]() ×0.15mol=0.4mol,故B错误;
×0.15mol=0.4mol,故B错误;
C.反应消耗氢氧化钠的物质的量为:n(NaOH)=n(OH﹣)=0.3mol,则加入的氢氧化钠溶液的体积至少为: ![]() =0.1L=100mL,若硝酸过量,则消耗的氢氧化钠溶液体积大于100mL,故C错误;
=0.1L=100mL,若硝酸过量,则消耗的氢氧化钠溶液体积大于100mL,故C错误;
D.根据反应方程式Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3可知,镁和铜的总的物质的量为铜离子物质的量的一半,即: ![]() =0.15mol,假定全为镁,金属质量为0.15mol×24g/mol=3.6g,若全为铜,金属质量为:0.15mol×64g/mol=9.6g,所以参加反应的金属的总质量(m)范围为:3.6g<m<9.6g,则金属质量不可能为3.4g,故D错误;
=0.15mol,假定全为镁,金属质量为0.15mol×24g/mol=3.6g,若全为铜,金属质量为:0.15mol×64g/mol=9.6g,所以参加反应的金属的总质量(m)范围为:3.6g<m<9.6g,则金属质量不可能为3.4g,故D错误;
故选A.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实行垃圾分类,关系广大人民群众生活环境,关系节约使用资源,也是社会文明水平的一个重要体现。有害垃圾指对人体健康或者自然环境造成直接或者潜在危害的生活废弃物。下列不属于有害垃圾的是
A.过期药物B.废旧电池C.废杀虫剂D.金属易拉罐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 除去乙醇中微量水用金属钠 B. 溴苯中混有溴,加入水萃取
C. 用酸性高锰酸钾除去乙烷中的乙烯 D. 可用分液漏斗分离硝基苯和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据下图作答:
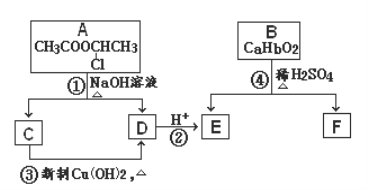
已知:一个碳原子上连有两个羟基时,易发生下列转化:![]()
(1)反应①所属的有机反应类型是_______________反应。
(2)反应③的化学方程式__________________________________________________。
(3)已知B的相对分子质量为162,其完全燃烧的产物中n(CO2)∶n (H2O) = 2∶1,则B的分子式为___________。
(4)F是高分子光阻剂生产中的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③苯环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为___________。
(5)化合物G是F的同分异构体,属于芳香族化合物,能发生银镜反应。G的结构有_____________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组将纯净的SO2气体通入0.1molL﹣1的Ba(NO3)2溶液中,得到了BaSO4沉淀.为探究上述溶液中何种微粒能氧化通入的SO2 , 该小组提出了如下假设:
假设一:溶液中的NO3﹣
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25mL0.1molL﹣1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
实验2:在盛有不含O2的25mL0.1molL﹣1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |
(2)为深入研究该反应,该小组还测得上述两个实验中溶液pH随通入SO2体积的变化曲线如图: 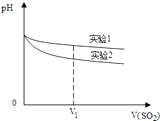
实验1中溶液pH变小的原因是;V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示).
(3)该小组还设计了实验验证假设二,请在实验4横线处写出实验步骤.
实验步骤 | 实验现象 | 结论 |
实验3:在盛有不含O2的25m10.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | ||
实验4: |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子分离膜可以让某些物质有选择地通过而将物质分离,下列应用不属于高分子分离膜的应用范围的是( )
A. 分离工业废水,回收废液中的有用成分
B. 食品工业中,浓缩天然果汁,乳制品加工和酿酒
C. 将化学能转换成电能,将热能转换成电能
D. 海水淡化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的过程中的能量变化情况,判断下列说法正确的是

A. H2(g)转化为氢原子是一个放热过程
B. 1molH2和1molCl2的总能量比2molHCl的总能量低
C. 1 个 HCl(g)分子中的化学键断裂时需要吸收431.8 kJ能量
D. 2HCl(g)= H2(g)+Cl2(g)的反应热ΔH=+184.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种化合物均由氢、氮、氧、铜四种元素中的两种组成.常温下,甲是一种含氮质量分数为87.5%的液态化合物,其相对分子质量与空气中某种主要成分的相对分子质量相等;乙和丙是铜的两种常见氧化物,乙是新制氢氧化铜与乙醛反应的还原产物.试回答下列问题:
(1)甲的结构式 .
(2)甲是一种二元弱碱,则甲与过量硫酸反应的产物为(写化学式).16g甲在空气中充分燃烧,生成一种常见液态物质和氮气,放出311kJ热量,则其热化学方程式为 .
(3)甲和丙反应的产物中含有乙和一种气态单质,写出其化学方程式 .
(4)向乙的固体中加入过量硫酸酸化的硫酸铁溶液,乙固体完全溶解,得到透明溶液.
①写出其离子方程式 .
②若所得溶液中阳离子浓度均约为0.1mol/L,再向所得混合溶液中加丙,最先得到沉淀(不同浓度的阳离子开始和完全以氢氧化物沉淀的pH如图).
③向上述混合液中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相)R2Cu(有机相)+2H+(水相),已知其它阳离子与该有机物不能发生反应,也不相溶.请设计实验方案,验证有机相中含有铜元素 . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com