
【题目】下列说法正确的是 ( )
A. 除去乙醇中微量水用金属钠 B. 溴苯中混有溴,加入水萃取
C. 用酸性高锰酸钾除去乙烷中的乙烯 D. 可用分液漏斗分离硝基苯和水
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ. 在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
(1)用D表示2 min内的平均反应速率为________,A的转化率为________。
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度________(填“增大”、“减
少”或“不变”)。
(3)若开始时只加C和D各4/3 mol,要使平衡时各物质的质量分数与原平衡相等,则还应加
入______ mol B物质。
(4)若向原平衡体系中再投入1 mol A和1 mol B,平衡________(填“右移”、“左移”或“不
移动”)。
Ⅱ.有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则 :
①每消耗1 mol CH4可以向外电路提供____ mol e-;
②负极电极反应式为__________________________________________;
③电池放电后,溶液的pH不断________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个研究性学习小组分别进行探究性的实验:
甲组:为了探究Cl2和SO2同时通入H2O中发生的反应,设计了如图所示的实验装置。
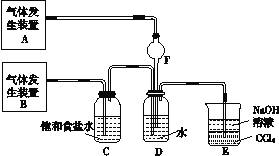
(1)气体发生装置A中产生的气体化学式为_______________________________。
(2)装置D中发生反应的化学方程式为__________________________________;
(3)装置E的作用是___________________________________________________。
乙组:为了分别研究SO2和Cl2的性质,设计了如图所示的实验装置。
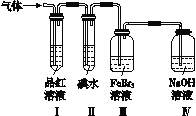
(4)当通入SO2时,装置Ⅲ中发生反应的离子方程式为________________;该反应中SO2表现出__________性。
(5)若装置Ⅱ中装有5.0 mL 1.0×10-3 mol·L-1碘水,当通入足量Cl2完全反应后,共转移了5.0×10-5 mol电子,则该反应的化学方程式为_____________________________。
(6)你认为乙组设计的装置是否有不足之处?__________(填“有”或“无”)。如果有,请写出改进方法:______________________________(如果无,此空不答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素X最高价含氧酸的化学式为HnXO2n-2,则在其气态氢化物中X元素的化合价为
A. -(3n-4) B. -(3n-12) C. -(12-3n) D. -(n-10)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列化学方程式中,能够用离子方程式Ba2++SO42-=BaSO4↓表示的是( )
A. BaCl2+K2SO4=BaSO4↓+2KCI
B. BaCO3+H2SO4=BaSO4↓+CO2↑+H2O
C. Ba(OH)2+H2SO4=BaSO4↓+2H2O
D. Ba(OH)2+2KHSO4=BaSO4↓+K2SO4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 用Pt电极电解少量的MgC12溶液:2H2O+2Cl-![]() H2↑+C12↑+2OH-
H2↑+C12↑+2OH-
B. 明矾溶液中加入Ba(OH)2溶液至生成的沉淀的质量最多:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
C. 向含有4 mol FeBr2的溶液中通入3 mol Cl2充分反应:2Fe2++4Br-+3Cl2=4Fe3++6Cl-+2Br2
D. 将1 mol Fe投入到含3 mol H NO3的稀硝酸溶液中:6Fe + 5NO3- + 20H+ =3Fe2+ +3Fe3+ + 11NO↑ +10H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)![]() SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是

A. 反应在c点达到平衡状态
B. 反应物浓度:a点小于b点
C. 反应物的总能量低于生成物的总能量
D. Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁、铜合金加入到稀硝酸中,合金完全溶解,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3mol/L的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述正确的是( )
A.反应中转移电子的总数为0.3mol
B.反应过程中,消耗硝酸的物质的量为0.3mol
C.沉淀完全时消耗NaOH溶液的体积为100mL
D.开始加入合金的质量可能为3.4g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com