
(14分)工业上可用软锰矿浆(主要成分为MnO2)吸收硫酸厂废气SO2,并制备MnSO4.H2O晶体,其工艺流程如下: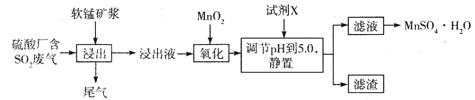
已知:①浸出液的pH<2,且阳离子主要是Mn2+,以及少量Fe2+、Al3+等。
②几种离子沉淀时数据信息如下:
请回答下列问题:
(1)浸出液pH <2的原因可能是_________________________________________。
(2)加入MnO2,氧化时溶液中反应的离子方程式为________________________ ,若流程中取消“加入MnO2”,对上述流程的影响是________________________________________。
(3)试剂X________(填“能”或“不能”)选用氢氧化锰,试说明理由:____________
______________________________________________________________________________。
(4)滤渣的主要成分是________,利用滤渣能提取铁红,其原理是______________________
______________________________________________________________________________。
(5)从滤液中提取MnSO4.H2O晶体的操作是____________________________________。
(1)部分SO2与水结合生成H2SO3,H2SO3电离出H+使pH<2(2分)
(2)MnO2+2Fe2++4H+ Mn2++2Fe3++2H2O(2分) 得到的产品中含有FeSO4杂质(2分)
Mn2++2Fe3++2H2O(2分) 得到的产品中含有FeSO4杂质(2分)
(3)能(1分) Fe3+、Al3+水解生成的H+与Mn(OH)2反应,促进Fe3+、Al3+水解并最终转化为沉淀,且不引入新的杂质(2分)
(4)Fe(OH)3、Al(OH)3(1分) 用足量NaOH溶液溶解滤渣,过滤得到Fe(OH)3,再灼烧即得铁红(2分)
(5)蒸发浓缩、冷却结晶、过滤(2分)
解析试题分析:
(1)部分SO2与水结合生成H2SO3,H2SO3电离出H+使pH<2
(2)MnO2+2Fe2++4H+ Mn2++2Fe3++2H2O; 得到的产品中含有FeSO4杂质
Mn2++2Fe3++2H2O; 得到的产品中含有FeSO4杂质
(3)能; Fe3+、Al3+水解生成的H+与Mn(OH)2反应,促进Fe3+、Al3+水解并最终转化为沉淀,且不引入新的杂质
(4)Fe(OH)3、Al(OH)3; 用足量NaOH溶液溶解滤渣,过滤得到Fe(OH)3,再灼烧即得铁红;
(5)蒸发浓缩、冷却结晶、过滤
考点:考查硫酸锰的工艺流程。


科目:高中化学 来源: 题型:单选题
下列实验现象及相关的离子方程式均正确的是( )
| A.碳酸钙粉末中加入醋酸溶液,固体质量减小,生成无色气体 CaCO3 + 2H+=Ca2+ + CO2↑ + H2O |
| B.向BaCl2溶液中通入SO2气体,出现白色沉淀:Ba2+ + SO2 + H2O = BaSO3↓ + 2H+ |
| C.向H2O2溶液中滴加酸化的KMnO4溶液,KMnO4溶液褪色 2MnO4- + 7H2O2 + 6H+ = 2Mn2+ + 6O2↑ + 10H2O |
| D.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合,生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3和少量的 SiO2、Fe2O3杂质)生产铵明矾晶体
NH4Al(SO4)2?12H2O,其工艺流程图如下: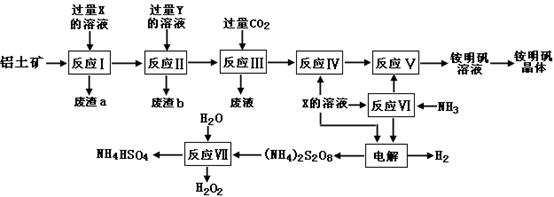
(1)废渣a、b 的成分分别是:_________、_____________。(写名称)
(2)流程图中X的化学式为:_______________。
(3)反应Ⅲ的离子方程式为:_________________________________________;从铵明矾溶液中获得铵明矾晶体的操作依次为(填操作名称)_________、冷却结晶、过滤洗涤。
(4)过硫酸铵[(NH4)2S2O8]在工业生产中有广泛的用途,可以作为氧化剂和漂白剂,广泛地用于蓄电池工业;还用作聚合的引发剂、纤维工业的脱浆剂。在上述的工艺流程中用惰性电极电解X与反应Ⅵ所得物质的混合溶液可以得到过硫酸铵。
写出阳极反应式:________________________ ____。
(5)反应Ⅶ的化学方程式为:_________________________ _____________;
NH4HSO4溶液中离子浓度由大到小顺序为:__________________________ _。
(6)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,不可能发生的反应是 (填选项字母)
| A.4NH4Al(SO4)2+3Ba(OH)2=2(NH4)2SO4+3BaSO4↓+ Al2 (SO4)3+2Al(OH)3↓ |
| B.2NH4Al(SO4)2+4Ba(OH)2=(NH4)2SO4+3BaSO4↓+Ba(AlO2)2 |
| C.2NH4Al(SO4)2+3Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓ |
| D.NH4Al(SO4)2+2Ba(OH)2=NH3·H2O+2BaSO4↓+ Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下列叙述I和II均正确并有因果关系的是
| 选项 | 叙述I | 叙述II |
| A | KNO3的溶解度大 | 用重结晶法除去KNO3中混有的NaCl |
| B | BaSO4难溶于酸 | 用盐酸和BaCl2溶液检验SO42- |
| C | NH3能使酚酞溶液变红 | NH3可用于设计喷泉实验 |
| D | Ca(OH)2能制成澄清石灰水 | 可配制2.0 mol?L-1的Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有杂质Fe2O3。利用明矾石来制取纯净的Al2O3、K2FeO4和H2SO4的工艺流程如图所示。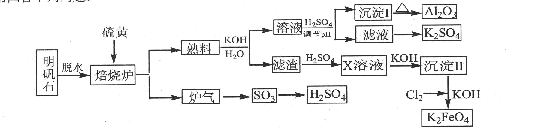
请回答下列问题:
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4) 2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3,转移的电子数目为 .
2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3,转移的电子数目为 .
(2)生成沉淀I的离子方程式为 ,沉淀II的化学式为 。
(3)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀I,证明沉淀I已洗涤干净的实验操作和现象是 。
(4)写出Cl2将沉淀Ⅱ氧化为K2FeO4的化学方程式: 。
(5)从滤液中得到K2SO4晶体的方法是 。
(6) K2FeO4也可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的
阳极反应式: .
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
废旧锂离子池的正极材料(主要含有LiCoO2及少量的Al、Fe等)可用于回收钴、锂,工艺流程如下:
(1)在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中发生反应的化学方程式为 ,还原产物是 。
(2)在上述除杂过程中,通入空气的作用是 废渣的主要成分是 。
(3)“沉淀钴”和“沉淀锂”的离子方程式分别为 。
(4)除了废渣可以回收利用外,本工艺还可回收的副产品是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学——选修2:化学与技术】(15分)
无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。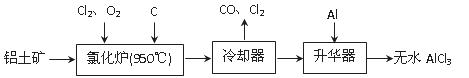
(1)氯化炉中Al2O3、C12和C反应的化学方程式为 。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为 。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是 。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式 、 。
②AlCl3产品的纯度为 。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是 。
(6)生铁中含有一种铁碳化合物(Fe3C),工业上要测定碳元素的质量分数,第一步是在足量的空气中煅烧,生成有磁性的固体,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
北京市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50 mg/kg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com