
【化学——选修2:化学与技术】(15分)
无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。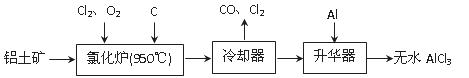
(1)氯化炉中Al2O3、C12和C反应的化学方程式为 。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为 。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是 。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式 、 。
②AlCl3产品的纯度为 。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是 。
(6)生铁中含有一种铁碳化合物(Fe3C),工业上要测定碳元素的质量分数,第一步是在足量的空气中煅烧,生成有磁性的固体,该反应的化学方程式是 。
(1)Al2O3+3Cl2+3C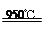 2AlCl3+3CO(2分)
2AlCl3+3CO(2分)
(2)SO32-+Cl2+H2O=SO42-+2Cl-+2H+(2分)
(3)除去FeCl3(2分)
(4)①Fe3++3OH-=Fe(OH)3↓(2分) Al3++4OH-=AlO2-+2H2O(2分)②96%(2分)
(5)在HCl气流中加热脱结晶水(2分)
(6)Fe3C+3O2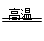 Fe3O4+CO2(1分)
Fe3O4+CO2(1分)
解析试题分析:⑴在氯化炉中发生的反应物有Al2O3、Cl2、C,生成物有AlCl3、CO(在冷却器中逸出),根据氧化还原反应的配平方法将其配平,并写出反应条件(950℃);
⑵书写Na2SO3溶液与Cl2反应的离子方程式时,先根据得失电子守恒有SO32-+Cl2――SO42-+2Cl-,再根据电荷守恒有SO32-+Cl2――SO42-+2Cl-+2H+,最后根据原子守恒得SO32-+Cl2+H2O=SO42-+2Cl-+2H+。
⑶由于升华器中含有AlCl3和FeCl3(杂质),加入少量Al,可与FeCl3反应将其除去。
⑷在含有FeCl3杂质的AlCl3产品中加入过量的NaOH溶液所发生的离子方程式有①Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O;沉淀物[Fe(OH)3]经洗涤、灼烧、冷却、称重,残留固体(Fe2O3)质量为0.32 g,据原子守恒可计算AlCl3产品的纯度: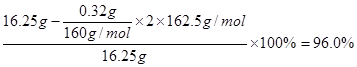 。
。
⑸为了抑制AlCl3的水解,必须在在HCl气流中加热AlCl3·6H2O,使其脱结晶水(否则会生成Al(OH)3或Al2O3)。
⑹据题意该反应的生成物有Fe3C、O2(空气),生成物有Fe3O4(磁性的固体)、CO2,根据氧化还原反应的配平方法将其配平,并标出反应条件(高温)。
考点:本题考查氧化还原反应方程式和离子方程式的书写、盐类的水解、根据化学反应方程式的化学计算(原子守恒)等。


科目:高中化学 来源: 题型:单选题
在某无色透明的酸性溶液中,能大量共存的离子组是
| A.Na+ 、K+、SO42-、HCO3- | B.Na十、Ba2+、NO3-、SO42- |
| C.Na+、 K+、Cl-、 NO3- | D.Fe3+、K+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)甲是一种盐,由A、B、C、D、E五种短周期元素元素组成。甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀。
③取少量甲溶液于试管中逐滴滴入NaOH溶液,生成沉淀的质量与滴入NaOH溶液的体积关系如图所示;
④取少量甲溶液于试管中,加入过量NaOH溶液并加热;
回答下列问题:
(1) D在周期表中的位置 写出化合物AB3的电子式
(2)经测定甲晶体的摩尔质量为453 g/mol,其中阳离子和阴离子物质的量之比1:1,且1 mol 甲晶体中含有12 mol结晶水。则甲晶体的化学式为 。
(3)实验③中根据图像得V(Oa):V(ab):V(bc)= 。
(4)实验④中离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)工业上可用软锰矿浆(主要成分为MnO2)吸收硫酸厂废气SO2,并制备MnSO4.H2O晶体,其工艺流程如下: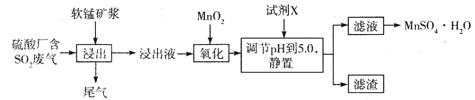
已知:①浸出液的pH<2,且阳离子主要是Mn2+,以及少量Fe2+、Al3+等。
②几种离子沉淀时数据信息如下:
请回答下列问题:
(1)浸出液pH <2的原因可能是_________________________________________。
(2)加入MnO2,氧化时溶液中反应的离子方程式为________________________ ,若流程中取消“加入MnO2”,对上述流程的影响是________________________________________。
(3)试剂X________(填“能”或“不能”)选用氢氧化锰,试说明理由:____________
______________________________________________________________________________。
(4)滤渣的主要成分是________,利用滤渣能提取铁红,其原理是______________________
______________________________________________________________________________。
(5)从滤液中提取MnSO4.H2O晶体的操作是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
| 离子 | 离子半径(pm) | 开始沉淀 时的pH | 完全沉淀 时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、 、
、 、
、 ,已知:
,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是 ;所含阴离子相同的两种盐的化学式是 。
(2)D的化学式为 ,D溶液显碱性的原因是 (用离子方程式表示)。
(3)A和C的溶液反应的离子方程式是 ;
E和氨水反应的离子方程式是 。
(4)若要检验B中所含的阳离子,正确的实验方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。
回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是______,正极发生的主要反应是________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是_______。
(2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
①图(b)中产物的化学式分别为A_______,B________。
②操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为_______。
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是 。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾NH4Al(SO4)2?12H2O,其工艺流程图如下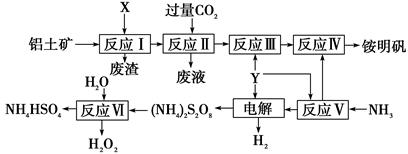
(1)流程图中X的电子式 , Y为 (填化学式)溶液
(2)反应Ⅱ的离子方程式为
(3)流程中可以循环使用的物质的名称是
(4)反应Ⅵ的化学方程式为
(5)对铵明矾NH4Al(SO4)2·12H2O高温分解的气体产物的预测不合理的是 。
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
(6)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中Al2O3和H2SO4的物质的量之比为____。
(7)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,不可能发生的反应是
A.4NH4Al(SO4)2+3Ba(OH)2=2(NH4)2SO4+3BaSO4↓+ Al2 (SO4)3+2Al(OH)3↓
B.2NH4Al(SO4)2+4Ba(OH)2=(NH4)2SO4+3BaSO4↓+Ba(AlO2)2
C.2NH4Al(SO4)2+3Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓
D.NH4Al(SO4)2+2Ba(OH)2=NH3·H2O+2BaSO4↓+ Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是
Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+)。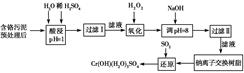
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 11.1 | 8 | 9(>9溶液) |

 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com