
(14分)明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有杂质Fe2O3。利用明矾石来制取纯净的Al2O3、K2FeO4和H2SO4的工艺流程如图所示。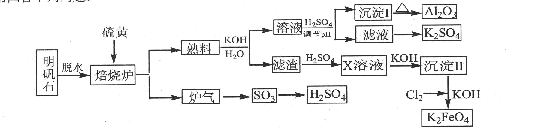
请回答下列问题:
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4) 2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3,转移的电子数目为 .
2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3,转移的电子数目为 .
(2)生成沉淀I的离子方程式为 ,沉淀II的化学式为 。
(3)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀I,证明沉淀I已洗涤干净的实验操作和现象是 。
(4)写出Cl2将沉淀Ⅱ氧化为K2FeO4的化学方程式: 。
(5)从滤液中得到K2SO4晶体的方法是 。
(6) K2FeO4也可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的
阳极反应式: .
(每空2分,共14分)
(1)3.612×1024或6NA
(2)AlO2-+H++H2O=Al(OH)3↓ Fe(OH)3
(3)取最后一次洗涤液少许于试管中,滴加BaCl2溶液,若无色白色沉淀生成,则已洗干净。
(4)2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O
(5)蒸发结晶
(6)Fe+8OH--6e-=FeO42-+4H2O
解析试题分析:(1)102gAl2O3的物质的量是1mol,即生成1molAl2O3时也生成3mol的二氧化硫,硫酸根离子中S元素的化合价为+6价,二氧化硫中的S元素的化合价为+4价,所以生成3mol的二氧化硫转移电子的物质的量是6mol,即3.612×1024或6NA;
(2)沉淀I是氢氧化铝沉淀,明矾石经过脱水、焙烧、与氢氧化钾溶液反应后得到的溶液中含有偏铝酸根离子,加入硫酸生成氢氧化铝沉淀,离子方程式为AlO2-+H++H2O=Al(OH)3↓ 沉淀II与氯气、氢氧化钾溶液反应生成高铁酸钾,所以沉淀II的化学式为 Fe(OH)3;
(3)氢氧化铝是偏铝酸钾溶液与硫酸溶液反应的产物,所以氢氧化铝沉淀中可能含有硫酸根离子,证明沉淀是否洗涤干净即证明洗涤液中是否含有硫酸根离子,证明方法是取最后一次洗涤液少许于试管中,滴加BaCl2溶液,若无色白色沉淀生成,则已洗干净。
(4)沉淀II与氯气、氢氧化钾溶液反应生成高铁酸钾,铁元素化合价升高,氯元素的化合价降低成为氯离子,化学方程式为2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O;
(5)从硫酸钾溶液中得到硫酸钾晶体的方法是蒸发结晶
(6)以铁为电极,电解浓的KOH溶液来制取K2FeO4,阳极发生氧化反应,K2FeO4中铁元素的化合价为+6价,所以铁失6个电子与氢氧根离子结合生成FeO42-,电极反应式为Fe+8OH--6e-=FeO42-+4H2O。
考点:考查氧化还原反应的计算,对反应流程图的分析,化学方程式的判断及书写,电化学原理的应用


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
在无色水溶液中能大量共存的一组离子是
| A.Na+、Ag+、Br-、MnO4- | B.K+、Al3+、AlO2-、SO42- |
| C.Fe3+、H+、I-、SO32- | D.Mg2+、NH4+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)往100 mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入的CO2的体积V(标准状况)与M的质量W的关系如下图所示。试解答下列问题:
(1)A点时,白色固体M的化学式为____________________,通入的CO2的体积为________ mL (标准状况下,下同)。
(2)C点时,白色固体M的化学式为____________________,通入的CO2的体积为________ mL。
(3)B点时M的组成成分为________(用化学式表示),通入的CO2的体积为________ mL。
(4)该NaOH溶液的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)甲是一种盐,由A、B、C、D、E五种短周期元素元素组成。甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀。
③取少量甲溶液于试管中逐滴滴入NaOH溶液,生成沉淀的质量与滴入NaOH溶液的体积关系如图所示;
④取少量甲溶液于试管中,加入过量NaOH溶液并加热;
回答下列问题:
(1) D在周期表中的位置 写出化合物AB3的电子式
(2)经测定甲晶体的摩尔质量为453 g/mol,其中阳离子和阴离子物质的量之比1:1,且1 mol 甲晶体中含有12 mol结晶水。则甲晶体的化学式为 。
(3)实验③中根据图像得V(Oa):V(ab):V(bc)= 。
(4)实验④中离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收H2S后的溶液加入到如题20图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e- S (n—1)S+ S2-
S (n—1)S+ S2- Sn2-
Sn2-
①写出电解时阴极的电极反应式: 。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成 。
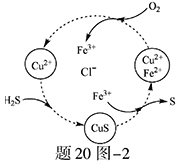
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如题20图—2所示。
①在图示的转化中,化合价不变的元素是 。
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为 。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有 。
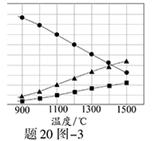
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如题20图—3所示,H2S在高温下分解反应的化学方程式为 。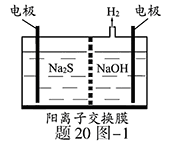
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)工业上可用软锰矿浆(主要成分为MnO2)吸收硫酸厂废气SO2,并制备MnSO4.H2O晶体,其工艺流程如下: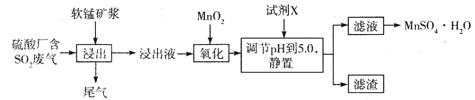
已知:①浸出液的pH<2,且阳离子主要是Mn2+,以及少量Fe2+、Al3+等。
②几种离子沉淀时数据信息如下:
请回答下列问题:
(1)浸出液pH <2的原因可能是_________________________________________。
(2)加入MnO2,氧化时溶液中反应的离子方程式为________________________ ,若流程中取消“加入MnO2”,对上述流程的影响是________________________________________。
(3)试剂X________(填“能”或“不能”)选用氢氧化锰,试说明理由:____________
______________________________________________________________________________。
(4)滤渣的主要成分是________,利用滤渣能提取铁红,其原理是______________________
______________________________________________________________________________。
(5)从滤液中提取MnSO4.H2O晶体的操作是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
| 离子 | 离子半径(pm) | 开始沉淀 时的pH | 完全沉淀 时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。
回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是______,正极发生的主要反应是________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是_______。
(2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
①图(b)中产物的化学式分别为A_______,B________。
②操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为_______。
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是 。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
请你参与识别化肥的探究活动,有五种化肥,分别是硫酸钾、氯化钾、碳酸氢铵、氯化铵和硝酸铵。
第一步:称取五种化肥各10 g,分别研细;
第二步:硝酸铵和熟石灰反应的化学方程式是:_____________________________________。
第三步:另取三种铵盐各少量,分盛于三支试管中,均滴入少量盐酸,无明显现象的是____________,有气泡放出的是________。反应的化学方程式:______________________________________________________________。
第四步:另取氯化铵和硝酸铵两种铵盐进行识别,写出识别时发生反应的化学方程式:_____________________________________________________________。
第五步:取两种钾盐,分别在试管中配成溶液,各滴入几滴氯化钡溶液,生成白色沉淀的钾盐是________,无明显现象的钾盐是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com